
工业生产硫酸时,其中一步反应是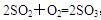 ,下列说法错误的是( )
,下列说法错误的是( )
A、增大氧气的浓度可提高反应速率
B、升高温度可提高反应速率
C、使用催化剂能显著增大反应速率
D、达到化学平衡时正逆反应速率相等且都为零
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将Na2O2逐渐加入到含有Al3+、Mg2+、NH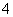 的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH
的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH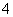
 的物质的量分别是
的物质的量分别是
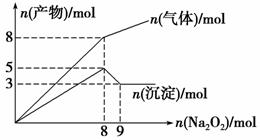
A.2 mol、3 mol、4 mol B.2 mol、3 mol、8 mol
C.3 mol、2 mol、8 mol D.3 mol、2 mol、4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,烧杯中装有稀硫酸,A、B、C、D分别为铜、锌、碳棒、碳棒,下列说法正确的是( )
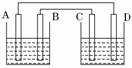
A.A、D棒上均产生气泡
B.B、C棒上均产生气泡
C.电子流动方向A→D
D.左边烧杯中溶液的pH会降低
查看答案和解析>>
科目:高中化学 来源: 题型:
以下关于化学反应速率的说法正确的是( )
A、化学反应速率可用某时刻生成物的质量增加来表示
B、在同一反应中,用各种物质表示的化学反应速率的大小相等
C、化学反应速率指单位时间内反应物浓度的减少或生成物浓度的增加
D、若反应现象在短时间内出现,则反应速率快,若无明显现象,则反应速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,NO(g)+CO(g) 
 N2(g)+CO2(g)ΔH=-373.2 kJ·mol-1。达到平衡后,为了提高该反应的速率和NO的转化率,采取的措施正确的是( )
N2(g)+CO2(g)ΔH=-373.2 kJ·mol-1。达到平衡后,为了提高该反应的速率和NO的转化率,采取的措施正确的是( )
A、加催化剂,同时升高温度
B、加催化剂,同时增大压强
C、升高温度,同时充入N2
D、降低温度,同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2催化剂2SO3的说法不正确的是( )
A、该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B、达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C、一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D、在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①101 kPa时,2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) ====H2O(l) ΔH=-57.3 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com