
【题目】(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2,二硫化亚铁)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)对反应NH3+O2—NO+H2O(未配平,反应条件略去)作分析,该反应中,还原剂是_______,还原产物是________,被还原的物质是_________。参加反应的氧化剂为3.2g时,反应转移的电子的物质的量为________________。
(3)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
【答案】SO2、Fe3O4 32 2Fe3++2I-=2Fe2++I2 NH3 NO、H2O O2 0.4mol 4H2O + 2CN— + O2 = 2HCO3— + 2NH3
【解析】
(1)①氧化产物是还原剂被氧化得到产物,根据反应方程式,化合价升高的元素是Fe、S,即氧化产物是Fe3O4和SO2;FeS2中Fe的化合价由+2价→+8/3价,S由-1价→+4价,3molFeS2参加反应,转移电子物质的量3×(2/3+2×5)mol=32mol;
②生成I2,利用Fe3+的强氧化性把I-氧化成I2,本身被还原成Fe2+,离子方程式为2Fe3++2I-=2Fe2++I2;
(2)还原剂是化合价升高的物质,根据反应方程式,还原剂为NH3;还原产物是氧化剂被还原的产物,即还原产物是NO和H2O;被还原物质的是氧化剂,即被还原物质为O2;3.2g氧化剂参与反应,转移电子物质的量为3.2×4/32mol=0.4mol;
(3)根据信息,得出CN-+O2→HCO3-+NH3,N元素化合价不发生变化,N化合价为-3价,CN-中C的化合价为+2价,HCO3-中C的化合价为+4价,O2中O的化合价降低,根据化合价升降法进行配平得出:2CN-+O2→2HCO3-+2NH3,
根据原子守恒,推出离子反应方程式为4H2O + 2CN- + O2 = 2HCO3- + 2NH3。


科目:高中化学 来源: 题型:
【题目】室温下,在pH=12的某溶液中,由水电离出来的OH-为( )
A.1.0×10-7 mol·L-1 B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1 D.1.0×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A. ![]() 、
、![]() B. AgCl、
B. AgCl、![]()
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.只有盐酸和硝酸中放出的氢气量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃某二元碱B(OH)2水溶液中,B2+、B(OH)+和B(OH)2三者各自的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是(已知多元碱的电离是逐级进行的)
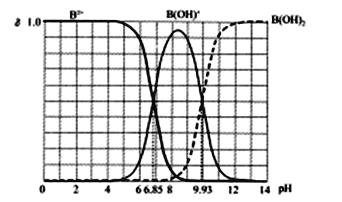
A. Kb2[B(OH)2]的数量级为10-8
B. 在B(OH)Cl溶液中c(OH-)>c(H+)
C. 等物质的量的BCl2和B(OH)Cl混合溶液中δ(B2+)<δ[B(OH)+]
D. B(OH)Cl溶液中,若c[B(OH)2]+2c(B2+)+c(H+)-c(OH-),则δ[B(OH)2]=δ[B(OH)+]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com