
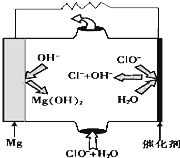
 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:| 1 |
| 2 |
| 1 |
| 2 |
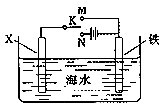
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
 Al(OH)3+3HCl生成HCl,氯化氢与空气中的水蒸气呈白雾,
Al(OH)3+3HCl生成HCl,氯化氢与空气中的水蒸气呈白雾, Al(OH)3+3HCl;
Al(OH)3+3HCl;
| ||
| ||


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、品红溶液中同时通入Cl2、SO2,漂白效果会更好 |
| B、加热可判断品红褪色是通入SO2还是通入Cl2引起的 |
| C、“无色化合物”分子中,19个碳原子都可能在同一平面上 |
| D、品红属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
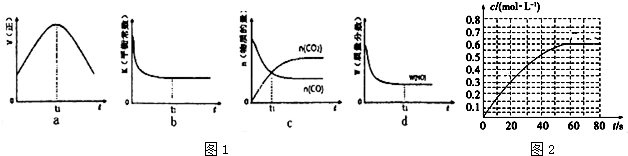
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
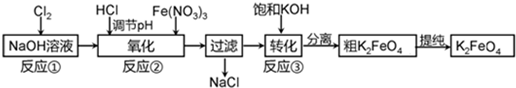
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1mol Fe3O4,反应转移的电子总数为2 mol | ||
| B、也可在酸性条件下用该方法制备Fe3O4纳米颗粒 | ||
C、反应每消耗1mol Fe2+,被Fe2+还原的O2的物质的量为
| ||
| D、x=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com