
| A. | 弱酸的电离常数越小,其所产生的盐水解的程度越大 | |
| B. | 溶液中发生的水解反应是A-+H2O?HA+OH- | |
| C. | 有关离子浓度大小关系是c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 该溶液是酸性 |
分析 A.二者恰好反应生成强碱弱酸盐MA,弱酸HA的酸性越弱,水解程度越大;
B.A-水解生成HA和氢氧根离子;
C.MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,恰好反应为MA,为强碱弱酸盐,A-水解,则c(M+)>c(A-),水解显碱性,则c(OH-)>c(H+),溶液中显性离子大于隐性离子,据此判断各离子浓度大小;
D.反应生成强碱弱酸盐,溶液呈碱性.
解答 解:A.越弱越水解,则弱酸的电离常数越小,其所产生的盐水解的程度越大,故A正确;
B.A-发生水解,水解的离子方程式为:A-+H2O?HA+OH-,故B正确;
C.MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,恰好反应为MA,为强碱弱酸盐,A-水解,则c(M+)>c(A-),水解显碱性,则c(OH-)>c(H+),溶液中显性离子大于隐性离子,则浓度关系为(M+)>c(A-)>c(OH-)>c(H+),故C正确;
D.二者恰好反应生成强碱弱酸盐MA,A-发生水解:A-+H2O?HA+OH-,溶液呈碱性,故D错误;
故选D.
点评 本题考查酸碱混合的定性判断、离子浓度大小比较,题目难度中等,明确混合后溶液中的溶质及盐类水解是解答的关键,注意显性离子与隐性离子的关系,试题有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol氧气与1mol二氧化硫的质量比约为2:1 | |
| B. | 2mol氧气与1mol二氧化硫的体积比约为1:1 | |
| C. | 1mol氧气与3mol二氧化硫的体积比约为1:3 | |
| D. | 1mol氧气与3mol二氧化硫的密度比约为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
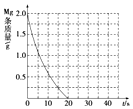
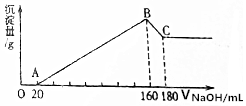 将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.
将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
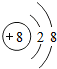 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式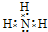 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
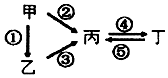 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | S | H2S | SO3 | H2SO4 |
| C | N2 | NH3 | NO | NO2 |
| D | Si | SiO2 | Na2SiO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验 编号 | 温度(K) | 盐酸浓度/ (mol•L-1) | 醋酸浓度/ (mol•L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究温度 对镁与盐酸反应速率的影响; II.实验a和c是探究浓度 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
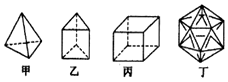
| A. | 1mol甲分子内含有10mol共价键 | B. | 乙分子的一氯取代产物只有一种 | ||
| C. | 丙分子的二氯取代产物只有两种 | D. | 丁分子显然是不可能合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇(CH3OH)和乙二醇(HOCH2CH2OH) | B. | 甲醛(HCHO)和乙醛 (CH3CHO) | ||
| C. | CH4和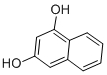 | D. | 苯(C6H6)和苯酚(C6H5OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com