
分析 ①氧族元素的氢化物的酸性,从上到下逐渐增强;
②多元弱酸盐的第一步水解程度大于第二步水解;
③酸性越强,对应盐的水解程度越强;
④盐的水解程度越大,水的电离程度越大;
⑤弱酸盐水解显碱性,酸越弱,盐的水解程度越大.
解答 解:①氧族元素的氢化物的酸性,从上到下逐渐增强,则酸性:H2S<H2Se,故错误;
②多元弱酸盐的第一步水解程度大于第二步水解,水解程度越大,溶液的碱性越强,所以碱性:Na2S>NaHS,故正确;
③酸性越强,对应盐的水解程度越大,溶液的碱性越强,酸性:HCOOH>CH3COOH,则碱性:HCOONa<CH3COONa,故错误;
④盐的水解程度越大,水的电离程度越大,醋酸的酸性大于氢氧化铝,则NaAlO2的水解程度大,所以水的电离程度:NaAc<NaAlO2,故正确;
⑤弱酸盐水解显碱性,酸越弱,盐的水解程度越大,Na2SO4不水解溶液显中性,NaHSO3显酸性,NaClO的水解程度大于NaHCO3,所以溶液的pH:NaHSO3<Na2SO4<NaHCO3<NaClO,故正确;
所以不正确的是①③.
故答案为;①③.
点评 本题考查了酸性强弱的比较、盐的水解原理的应用等知识点,难度中等,注意电离程度越小的物质,其阴离子结合氢离子能力越强,即水解程度越大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| D. | 酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硝基苯的结构简式: | |
| C. | (CH3 CH2)2 CHCH2CH3 的名称:2-乙基丁烷 | |
| D. | 甲基的电子式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
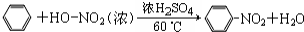 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LSO2中含有的分子数为0.5NA | |
| D. | 23g钠与足量氧气充分反应,转移的电子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H14含有四个甲基的烃的一氯取代物的异构体数目为5 | |
| B. | 分子式为C5H10异构体数目为5 | |
| C. | 分子式为C4H10O的醇类异构体数目为4 | |
| D. | 分子式为C6H12O2羧酸类异构体数目为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验内容 | 实验目的 |
| A | 用平行光照射 | 区别淀粉溶液和氯化钠溶液 |
| B | 加入CaCO3粉末,充分反应后过滤 | 除去CaCl2溶液中的FeCl3 |
| C | 通过灼烧的Cu粉末,收集气体 | 除去N2中的少量O2 |
| D | 滴入稀盐酸,同时用pH计测定至溶液呈中性 | 除去KNO3溶液中的KOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com