
【题目】(1)写出下列物质的化学式:①钡餐:_____。②漂白粉的有效成分_____。
(2)汤姆生发现了电子,提出了____________式的原子结构模型;接触法制硫酸工艺中,在设备_________中发生SO2的催化氧化。
(3)镁燃烧不能用CO2灭火,用化学方程式表示其理由:____________________________________。
(4)写出木炭与浓硫酸共热时发生的化学反应方程式: ____________________________________。
【答案】 BaSO4 Ca(ClO)2 葡萄干面包 接触室 2Mg+CO2![]() 2MgO+C C+2H2SO4 (浓)
2MgO+C C+2H2SO4 (浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】(1) ①钡餐即硫酸钡的化学式为BaSO4,②漂白粉的有效成分为次氯酸钙,其化学式为Ca(ClO)2;
(2) 汤姆生于1897年发现了电子,提出了葡萄干面包式的原子结构模型,触法制硫酸工艺中,在接触室中发生SO2的催化氧化;
(3)因为CO2中的C是+4价,具有一定的氧化性,而镁属于活泼金属,还原性强,所以镁燃烧不能用CO2灭火,反应的化学方程式为2Mg+CO2![]() 2MgO+C;
2MgO+C;
(4)木炭与浓硫酸共热时发生的化学反应方程式C+2H2SO4 (浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3H2O
B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O
C.用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑
D.电解MgCl2水溶液的离子方程式:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一个装有活塞的密闭容器,内盛有22.4mL的NO,若通入11.2mL的O2(体积为标况下测得),保持温度,压强不变,则容器中的密度为( ) ![]()
A.等于1.369g/L
B.等于2.054g/L
C.于1.369g/L和2.054g/L之间
D.大于2.054g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个6L的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+3Y(g)=2Q(g)+nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小 ![]() ,则该反应方程式中n的值是( )
,则该反应方程式中n的值是( )
A.3
B.4
C.5
D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 浓硝酸 | Cu | NO2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
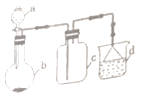
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
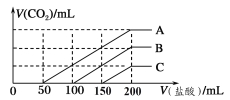
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件.某课外小组采用碘量法测定学校周边河水中的溶解氧.实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度.将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2 , 实现氧的固定.
Ⅱ.酸化、滴定
在碘量瓶中将因氧后的水样酸化,MnO(OH)2被I﹣还原为Mn2+(该反应放热),在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O ![]() +I2═2I﹣+S4O
+I2═2I﹣+S4O ![]() )
)
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为 .
(2)水样酸化后发生反应的离子方程式 .
(3)在碘量瓶(如图)中进行反应,要盖上塞子且在塞子上倒少量水,这样做的目的是 . 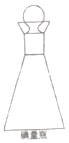
(4)Na2S2O3溶液不稳定,易被氧化,且易受到水中CO2以及微生物的影响而分解,配制该溶液时需要的蒸馏水必须经过煮沸、冷却后才能使用,其目的是 .
(5)Na2S2O3溶液不稳定,使用前需标定,KIO3做其准物标定Na2S2O3溶液的浓度,称取0.214g KIO3与过量的KI作用,析出的碘用Na2S2O3溶液滴定,用去24.00mL,此Na2S2O3溶液的浓度为(已知M(KIO3)=214.0gmol﹣1)
(6)取100.00mL 水样经固氧、酸化后,用该 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为;若消耗Na2S2O3溶液的体积为10mL,则水样中溶解氧的含量为mgL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com