
| A. | NH4+ | B. | Mg2+ | C. | Cu2+ | D. | Fe3+ |
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1氯化铵溶液中:c(H+)>c(OH-)>c(Cl-)>c(NH4+) | |
| B. | pH=2的醋酸中:c(H+)=0.02mol•L-1 | |
| C. | 饱和碳酸钠溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | pH=12的NaOH溶液与pH=2 CH3COOH混合后所得溶液中:c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管里的油污先用热的纯碱溶液洗,再用清水冲洗 | |
| B. | 先把试管里的废液倒入下水道中,再用清水冲洗 | |
| C. | 附有氢氧化铁沉淀的试管,先用烧碱溶解,再用清水冲洗 | |
| D. | 盛放石灰水后残留下固体物质的烧杯,先用肥皂水洗,再用清水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4 KJ•mol-1 | |
| B. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol?L-1 | |
| C. | 当V=20时,溶液中:c(Na+)>c(F-)>c(OH-)>c(H+) | |
| D. | 当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
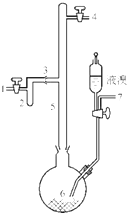 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com