
根据以下三个热化学反应方程式:2H2S(g)+3O2(g) =2SO2(g)+2H2O(l)  H= -Q1 kJ/mol;
H= -Q1 kJ/mol;
2H2S(g)+O2(g) =2S(s) +2H2O(l)  H= -Q2kJ/mol;
H= -Q2kJ/mol;
2H2S(g)+O2(g) =2S(s)+2H2O(g)  H= -Q3kJ/mol。
H= -Q3kJ/mol。
判断Q1、Q2、Q3三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
科目:高中化学 来源: 题型:单选题
未来新能源的特点是资源丰富、对环境污染小,且可以再生。下列属于未来新能源的是
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
| A.①②③④ | B.③⑤⑥⑦ | C.④⑤⑥⑦ | D.①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
镁粉与碘粉均匀混合,滴加几滴水,发生剧烈反应,并产生大量紫色蒸气。以下叙述错误的是
| A.H2O作催化剂 | B.紫色蒸气是I2 |
| C.该反应是放热反应 | D.反应后物质的总能量升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如下图转化。下列说法不正确的是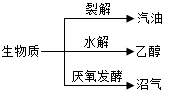
| A.汽油属于纯净物 |
| B.乙醇属于可再生能源 |
| C.沼气的主要成分是甲烷 |
| D.生物质能来源于太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
②3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+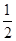 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系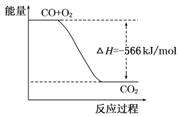 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=+906 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com