
常温下,下列有关电解质溶液的说法正确的是
A.pH=3的强酸溶液1ml,加水稀释至100ml后,溶液pH降低2个单位
B.0.2molCO2通入1L0.3mol·L-1 KOH溶液中:2c(H+)+ c(HCO3-)+ 3c(H2CO3)=2c(OH-)+c(CO32-)
C.已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
D.pH相同的①CH3COONa ②NaHCO3③NaClO三种溶液中的c(Na+):①<②<③
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:计算题
常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Br—Br | H—Br |
键能/(kJ·mol-1) | 436 | 193 | 366 |
请计算H2(g)+Br2(g)==2HBr(g)的反应热( )
A.+103 kJ·mol-1 B.+679 kJ·mol-1 C.-103 kJ·mol-1 D.+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,在等体积、等浓度的硝酸中加入 氨水,溶液的导电性增强
氨水,溶液的导电性增强
C.25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当
D.25℃时,将等体积pH=1的盐酸和水混合,混合后溶液的pH=1.3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:填空题
(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
室温时,向20mL 0.1mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述,正确的是
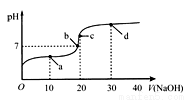
A.a点时:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定条件下一定能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl-、HCO3-
B.无色溶液中:Al3+、NH4+、Cl-、HCO3-
C.pH=1的溶液中:ClO-、SO42-、Fe2+、K+
D.由水电离的c(OH-)=10-14mol· L-1的溶液中:CH3COO-、SO42-、Na+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| C. | 水中的钢闸门连接电源的负极,属于外加电流的阴极保护法 | |
| D. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅣA族元素氢化物沸点:SiH4>CH4,所以ⅤA族元素氢化物沸点:PH3>NH3 | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,第三周期元素氢化物稳定性:HCl>H2S | |
| C. | ⅦA族元素的非金属性:F>Cl,所以ⅦA族元素氢化物的酸性:HF<HCl | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com