
下列变化过程中,只破坏共价键的是( )
A.I2升华 B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸 D.从NH4HCO3中闻到了刺激性气味
科目:高中化学 来源: 题型:
已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
(1)与组成A分子的原子的元素同族的上一周期的元素具有相同核外电子数的单核离子中,氧化性最强的 ,该离子与氢氧根离子结合生成的产物的电离方程式为 。
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”)。B分子中心原子的最高价氧化物的浓溶液可以和B反应,写出该化学反应方程式并用单线桥标出电子转移的方向和数目 。
(3)C与另一种含有18个电子的4原子分子可以发生氧化还原反应,生成无污染的物质,该反应可以做为火箭发射原理,请写出该反应方程式 。
(4)D、氧气,氢氧化钠溶液和惰性电极可设计出一种燃料电池,则该燃料电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
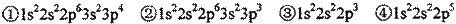
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中前7周期的元素种数如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
请分析周期表与元素种数的关系,然后预言第8周期最多可能含有的元素种数( )
A.18 B.32 C.50 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
下表标出的是元素周期表的一部分元素,回答下列问题:
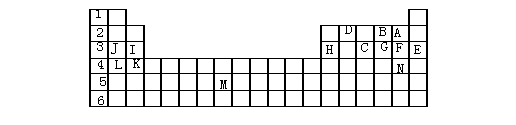 |
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积一定的密闭容器中进行如下反应:X2(g)+2Y2(g)  2 Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是 ( )
2 Z(g),已知X2、Y2、Z的起始浓度分别为a mol/L、b mol/L、 0.2mol/L(非平衡态),在一定条件下,当反应达到平衡时,Z的浓度为 0.3mol/L,则下列判断正确的是 ( )
A.b ≤ 0.1mol/L
B.达平衡时,X2的正反应速率与Y2的逆反应速率相等
C.a ≥ 0.05 mol/L
D.该平衡时气体物质的量浓度之和小于(a+ b+0.2)mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:



 —→
—→ —→产品
—→产品

已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_______________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com