
【题目】可逆反应:3A(g)![]() 3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. 若C为固体,则B一定是气体
C. B和C一定都是气体 D. B和C不可能都是气体
【答案】B
【解析】3A(g)3B(?)+C(?)(△H>0),该正反应吸热,温度升高,平衡右移, ![]() 变小,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定。A、若B和C都是固体,只有A一种气体,
变小,平均摩尔质量的变化,由反应前后气体物质的量变化、混合气体的质量变化决定。A、若B和C都是固体,只有A一种气体, ![]() 不变,故A错误;B、若C为固体,B为气体,反应前后气体物质的量不变,气体质量减小,
不变,故A错误;B、若C为固体,B为气体,反应前后气体物质的量不变,气体质量减小, ![]() 减小,结合A的分析,B一定为气体,故B正确;C、若B和C都是气体,反应前后气体物质的量一定增大,质量不变,
减小,结合A的分析,B一定为气体,故B正确;C、若B和C都是气体,反应前后气体物质的量一定增大,质量不变, ![]() 减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小,
减小,但若B为气体,C为固体,反应前后气体物质的量不变,气体质量减小, ![]() 减小,故C错误;D、根据C的分析,若B和C都是气体,反应前后气体物质的量一定增大,质量不变,
减小,故C错误;D、根据C的分析,若B和C都是气体,反应前后气体物质的量一定增大,质量不变, ![]() 减小,故D错误;故选B。
减小,故D错误;故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,△H>0,下列叙述正确的是( )
H++OH-,△H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw不变,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的最高价氧化物对应的水化物的化学式是H2RO4,这种元素的气态氢化物的化学式是( )
A. HRB. H2R C. RH3 D. RH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列不正确的是
A. 离子半径:Na+>Mg2+>Al3+>F—
B. 热稳定性:HCl>H2S>PH3
C. 酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4
D. 熔点:SiO2>NaCl>Na>CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.蛋白质、纤维素、蔗糖、聚乙烯、淀粉都是高分子化合物
B.石油、煤、天然气、可燃冰、植物油都属于化石燃料
C.完全燃烧只生成CO2和H2O的化合物一定是烃
D.乙烯、乙醇、SO2、FeSO4都能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到平衡状态的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成 b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变 d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_________(填字母)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
③cl_________c2(填“>”、“<”或“=”),a=_________。
④该温度下反应的平衡常数K=_________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=_________。
(2)已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
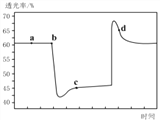
A.b点的操作是压缩注射器
B.d点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02molL﹣1 . 在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.请回答下列问题:
(1)前2s以N2O4的浓度变化表示的平均反应速率为;
(2)平衡时,NO2的体积分数为;
(3)平衡时,N2O4的转化率为;
(4)平衡时,混合气体的平均摩尔质量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com