
.(9分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,
性质稳定,请回答:
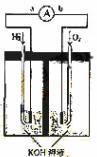
![]() (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 ![]() (用a、b 表示)。
(用a、b 表示)。
![]() (2)负极反应式为 。
(2)负极反应式为 。
![]() (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省开原高中高一下学期期中考试化学试卷(带解析) 题型:填空题
(9分)(1)X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示,则四种金属的活泼性由强到弱的顺序为______ _____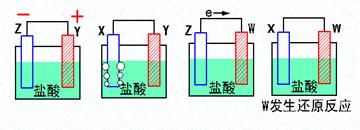
(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极 、负极
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省高一下学期期中考试化学试卷(解析版) 题型:填空题
(9分)(1)X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示,则四种金属的活泼性由强到弱的顺序为______ _____
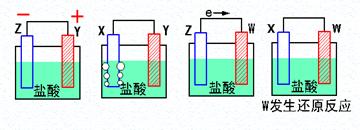
(2)假设第一个装置中两个金属片一个是铝片一个是铜片,电解质溶液是盐酸,请写出两极的电极反应式:正极 、负极
(3)用KOH溶液做电解质溶液的氢氧燃料电池的正极反应式
查看答案和解析>>
科目:高中化学 来源:2012届江西省抚州市教研室高二上学期期末考试化学试卷 题型:填空题
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。

(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g);ΔH=-92.4 kJ/mol,
2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com