
【题目】下列有关1mol O2的说法中,不正确的是(NA表示阿伏伽德罗常数)( )
A.质量为32g
B.含氧原子数为NA
C.含氧分子数为NA
D.在标准状况下,体积约为22.4L
科目:高中化学 来源: 题型:
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
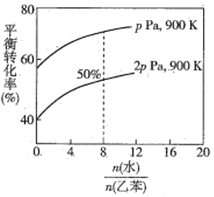
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛: ![]() (g) + 2O2→
(g) + 2O2→![]() + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中的相关描叙中,不正确的是
A. 常温下,Ksp[R(OH)3]=1.0×10-38,在c(R3+)=0.010mol/L的溶液中,当pH≥2.0时R3+开始沉淀
B. 常温下,将0.1mol/LCH3COOH溶液加水稀释,当溶液的pH从3.0开到5.0时,溶液中c(CH3COO-)/(CH3COOH)的值增大到原米的100倍
C. 0.02mol/L的NaOH溶液与0.02mol/L的NaHC2O4溶液等体积混合后,则有: c(Na+)=2[c(C2O42-)+c(HC204-)+c(H2C2O4)]
D. 常温下,将1.0mol/L硫酸与amol/L氨水等体积混合至溶液呈中性,则NH4+的水解常数(Kh)计算式为=(a-1)×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是
①KMnO4(H+,aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
A.①⑤B.②③
C.全部D.都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是
A. 2.4g金属镁所含电子数目为0.2NA
B. 16g CH4所含原子数目为NA
C. 17gNH3所含质子数目为17 NA
D. 18g水所含分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中将盛有甲烷与氯气的混合气体的量筒倒立在盛有饱和食盐水的水槽中,光照使其发生反应,下列说法错误的是( )

A. 通过量筒内壁上出现的油状液滴可以说明生成四种有机产物
B. 氯化氢极易溶于水,导致量筒中液面上升
C. 饱和食盐水能够抑制氯气的溶解
D. 量筒中气体颜色逐渐变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系错误的是( )
A.0.1 mol?L﹣1 CH3COOH溶液中:c(CH3COO﹣)+c(OH﹣)=c(H+)
B.0.1 mol?L﹣1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO ![]() )+c(OH﹣)
)+c(OH﹣)
C.25℃时,有等浓度的①NH4HSO4溶液、②NH4HCO3溶液中c(NH ![]() ):①>②
):①>②
D.含等物质的量的NaX和弱酸(HX)混合溶液中一定存在:c(Na+)>c(X﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳化学”是绿色化学的重要组成部分。
(1)由CO2制备甲醇的过程发生的主要反应如下:
反应I: CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H 1<0;
CH3OH(g)+ H2O(g) △H 1<0;
向2 L恒容密闭容器中充入3molH2和1.5molCO2,在一定条件下该反应l0min时达到平衡状态,二氧化碳的转化率a(CO2)=60%,则v(H2) =_________________________。(填字母)。
若要同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2的浓度
(2)已知: CO2(g)+ 2H2(g)![]() C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
(3)在某条件下,将4molH2和1molCO2,置于2L密闭容器中发生反应:
反应II :CO2(g)+4H(g) ![]() CH4(g)+2H2O(g) △H2
CH4(g)+2H2O(g) △H2
反应Ⅲ: CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
CO2转化率、CH4和CO 选择性随温度变化情况分别如图所示(选择性: 转化的CO2中生成CH4或CO 的百分比)。
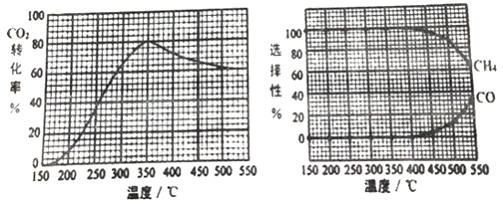
①反应II的△H2________(填“>”、“<“或“=")0,理由是_________________________。
②350℃时,反应II 的平衡常数K=_______。为减少CO 在产物中的比率,可采取______的措施有______(例举一例回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com