
���� ��1�����û�ѧƽ������ʽ����ƽ��ʱ��t-BuNO��2����t-BuNO����Ũ�ȣ�����ƽ�ⳣ��k=$\frac{{c}^{2}[��t-BuNO��]}{c[��t-BuNO��_{2}]}$���㣻
��2��һ���¶��£����ţ�t-BuNO��2����ʼŨ���������ӷ�Ӧ�t-BuNO��2��Ũ�ȣ���Ȼƽ
��������Ӧ�����ƶ��������� ��t-BuNO��2����ʼŨ��������ƽ��ת�����Ǽ�С�ģ�
�����¶�20�治�䣬���֣�t-BuNO��2��ʼŨ����ͬ��ƽ��ת����ԽС��KֵԽС�����ƽ�ⳣ���жϣ�
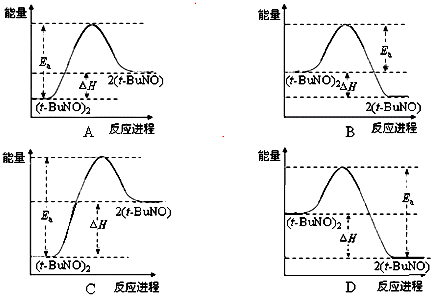
��3����ʵ���ø÷�Ӧ�ġ�H=+50.5 kJ•mol-1����֪�÷�Ӧ�����ȷ�Ӧ����Ӧ���������������������������������ݻ��Ea=90.4 kJ•mol-1��Ea-��H��50.5kJ•mol-1��
��� �⣺��֪20��ʱ��t-BuNO��2��ƽ��ת���ʦ�=65%����
��t-BuNO��2?2��t-BuNO��
��ʼ��mol/L����0.5 0
�仯��mol/L����0.5��0.65 2��0.5��0.65
ƽ�⣨mol/L����0.5��0.35 2��0.5��0.65
ƽ�ⳣ��k=$\frac{{c}^{2}[��t-BuNO��]}{c[��t-BuNO��_{2}]}$=$\frac{��0.5��65%��2��^{2}}{0.5��0.35}$=2.4��
�ʴ�Ϊ��2.4��
��2��һ���¶��£����ţ�t-BuNO��2����ʼŨ���������ӷ�Ӧ�t-BuNO��2��Ũ�ȣ���Ȼƽ��������Ӧ�����ƶ��������� ��t-BuNO��2����ʼŨ��������ƽ��ת�����Ǽ�С�ģ�
�÷�Ӧ��CCl4�ܼ��е�ƽ�ⳣ��Ϊ1.9��С�����������ܼ��е�ƽ�ⳣ��2.4�������¶�20�治�䣬���֣�t-BuNO��2��ʼŨ����ͬ��ƽ��ת����ԽС��KֵԽС����t-BuNO��2����CCl4�ܼ��е�ƽ��ת����С�������������ܼ��е�ƽ��ת���ʣ�
�ʴ�Ϊ����С��С�ڣ�
��3����ʵ���ø÷�Ӧ�ġ�H=+50.5 kJ•mol-1����֪�÷�Ӧ�����ȷ�Ӧ����Ӧ�������������������������������ų�������ϵͼB��D�������ݻ��Ea=90.4 kJ•mol-1��Ea-��H��50.5kJ•mol-1��������ϵͼA��Ea-��H��50.5 kJ•mol-1��Ea���H�ı������ԣ���������ϵͼC�Ǻ����ģ�
�ʴ�Ϊ��C��
���� ��Ŀ������û��ѧ������������ʽ��ʾ�ķ�ӦҲû�м����dz�İ���������������������ϵ��Ѷȣ���ʵ��һ����ͨ�ķֽⷴӦ��һ�����淴Ӧ��ע������ƽ�ⳣ��������ת���ʹ�ϵ����3����ע��A��Cͼ��Ea���H�ı�����ϵ��Ϊ�״��㣬�ѶȽϴ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ʵ������ | B�� | O2��O3������С | ||
| C�� | ��������ķ�����Ŀ��� | D�� | ���������е���ԭ����Ŀ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 N2O4��g���Ѵ�ƽ��״̬����Ӧ�Ƿ��ȷ�Ӧ������ʱ�����¶��½���ƽ��������Ӧ�����ƶ���NO2Ũ�Ƚ��ͣ�[��֪2NO2��g��?N2O4��g���ڼ����ڼ��ɴﵽ��ѧƽ��]��
N2O4��g���Ѵ�ƽ��״̬����Ӧ�Ƿ��ȷ�Ӧ������ʱ�����¶��½���ƽ��������Ӧ�����ƶ���NO2Ũ�Ƚ��ͣ�[��֪2NO2��g��?N2O4��g���ڼ����ڼ��ɴﵽ��ѧƽ��]���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| ��ѹǿp/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A�� | ��Ӧ��t1 min�ڵ�ƽ������Ϊv��H2��=$\frac{0.40}{{t}_{1}}$mol•L-1•min-1 | |
| B�� | ���������������䣬��ʼʱ�������г���0.60mol CO��1.20mol H2O������ƽ��ʱn��CO2��=0.40mol | |
| C�� | ���������������䣬��ƽ����ϵ����ͨ��0.20mol H2O��g������H���� | |
| D�� | �¶�������800�棬������Ӧƽ�ⳣ��Ϊ0.64��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ʒ�ĸ�ʴ�������ⸯʴΪ�� | |
| B�� | �����г���̼������Һϴ�Ӳ;��ϵ����� | |
| C�� | ����[KAl��SO4��2•12H2O]����ˮ��ɱ������ | |
| D�� | ���Ͳ��Ͼ�����ά�����ά�������л��߷��Ӳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��ˮAlCl3��һ����Ҫ�Ļ���ԭ�ϣ�ij����̽��С�鳢����ȡ��ˮAlCl3���������ϻ��������Ϣ����ˮAlCl3��178�����������׳��⣬��ˮ����������ɫ������
��ˮAlCl3��һ����Ҫ�Ļ���ԭ�ϣ�ij����̽��С�鳢����ȡ��ˮAlCl3���������ϻ��������Ϣ����ˮAlCl3��178�����������׳��⣬��ˮ����������ɫ������| ��һ��ʵ�� | �ڶ���ʵ�� | ������ʵ�� | |
| D������� | 2.0g | 2.0g | 2.0g |
| ��������� | 334.5mL | 336.0mL | 337.5mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ȼ����Ϊ890.3 kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3 kJ•mol-1 | |
| B�� | ��101 kPaʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ 2H2��g��+O2��g��=2H2O��l����H=-571.6 kJ•mol-1 | |
| C�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3 kJ•mol-1����CH3COOH��aq��+NaOH��aq��=CH3COONa��aq��+H2O��l����H=-57.3kJ•mol-1 | |
| D�� | 500�桢30 MPa�£���0.5 mol N2��g����1.5 mol H2��g�������ܱ������г�ַ�Ӧ����NH3��g������19.3 kJ�����Ȼ�ѧ����ʽΪN2��g��+3H2��g��?2NH3��g����H=-38.6 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢܢ� | B�� | �ڢۢܢ� | C�� | �ۢܢݢ� | D�� | �ڢۢܢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com