
下列是以芳香烃A为原料制备扁桃酸( )的流程图。请回答下列问题:
)的流程图。请回答下列问题:

(1)A的结构简式为________,D中官能团的名称是________。
(2)C中所有碳原子________(填“能”或“不能”)共面,产物B的结构简式可能有两种,分别为________。
(3)写出下列反应的化学方程式:
E→F:________________________________________________________;
G→H:_______________________________________________________。
(4)上述转换中属于加成反应的是________(填序号)。
(5)设计实验证明物质B含有氯元素________________________________
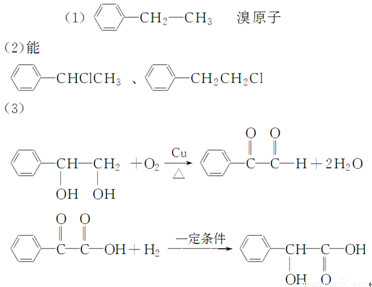
(4)③⑦
(5)取适量的物质B与NaOH水溶液混合加热,待反应完全后冷却混合溶液至室温,先后加入稍过量的HNO3溶液、AgNO3溶液,如果有白色沉淀析出则证明B中有氯元素
【解析】 在整个转化过程中,碳链没有发生变化,因此根据扁桃酸H的结构简式确定A为乙苯,乙苯与氯气在光照条件下发生取代反应,生成一氯代物B,氯原子取代的位置不同,将有两种不同的结构( ),B中的氯原子可以用氢氧化钠的水溶液加热,发生水解反应得到氯离子,用银离子检验氯离子的存在,进而确定B中含有氯元素。在氢氧化钠的醇溶液中B发生消去反应,生成苯乙烯C,根据苯环的平面结构和乙烯的平面结构确定,有可能苯乙烯中所有的原子均在同一平面上,C中含有碳碳双键,与溴的四氯化碳溶液发生加成反应生成D(
),B中的氯原子可以用氢氧化钠的水溶液加热,发生水解反应得到氯离子,用银离子检验氯离子的存在,进而确定B中含有氯元素。在氢氧化钠的醇溶液中B发生消去反应,生成苯乙烯C,根据苯环的平面结构和乙烯的平面结构确定,有可能苯乙烯中所有的原子均在同一平面上,C中含有碳碳双键,与溴的四氯化碳溶液发生加成反应生成D(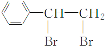 ),D在氢氧化钠的水溶液中发生取代反应引入羟基生成E(
),D在氢氧化钠的水溶液中发生取代反应引入羟基生成E( ),E经氧化得到F(
),E经氧化得到F(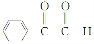 ),再次氧化得到G(
),再次氧化得到G( ),G与氢气发生加成反应得到扁桃酸H(
),G与氢气发生加成反应得到扁桃酸H(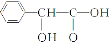 )。
)。


科目:高中化学 来源:2014年高考化学指导冲关 第5练化学反应速率和化学平衡练习卷(解析版) 题型:填空题
(1)(浙江高考)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(2)(天津高考)写出WO3(s)+3H2(g)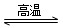 W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。
(3)(福建高考)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)??2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:________。
物质ABCD
起始投料/mol2120
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第2练氧化还原反应和离子反应练习卷(解析版) 题型:选择题
下列对各组离子或物质是否能够大量共存解释正确的是( )
A常温常压下NH3、O2、H2、CO2不能共存NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3
Bc(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO3—、SO42—、Na+ 不能共存 发生反应:3Fe2++NO3—+4H+=3Fe3++NO↑+2H2O
C溶液中:K+、Cu2+、Cl-、NH3·H2O不能共存发生反应:Cu2++2OH-=Cu(OH)2↓
D溶液中:Al3+、Na+、SO42—、HCO3—可以共存不能发生反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第1练物质分类化学用语和常用计量练习卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol甲基(—CH3)中含有电子数为7NA
B.25 ℃时,pH=7的NH4Cl和NH3·H2O的混合溶液中,OH-数为10-7NA
C.4.6 g乙醇中含有共价键数目为0.8NA
D.两份均为2.7 g的铝样品分别与100 mL浓度均为2 mol·L-1的盐酸和氢氧化钠溶液充分反应,转移电子数均为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第1练物质分类化学用语和常用计量练习卷(解析版) 题型:选择题
下列有关叙述正确的是( )
A.氯化钠的水溶液能导电,食盐水是电解质
B.氯气的水溶液能导电,但氯气是非电解质
C.H2SO4液态时不导电,它是非电解质
D.MgCl2在熔融状态下可导电,它是电解质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第15练有机化合物的推断与合成练习卷(解析版) 题型:填空题
华法林是一种治疗心脑血管疾病的药物,可由化合物E和M在一定条件下合成得到(部分反应条件略)。
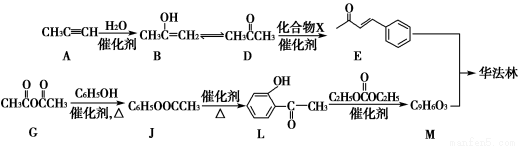
(1)A的名称为________,A→B的反应类型为________。
(2)D→E的反应中,加入的化合物X与新制Cu(OH)2反应产生红色沉淀的化学方程式为____________________________________
(3)G→J为取代反应,其另一产物分子中的官能团是________。
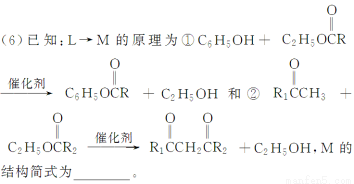
(4)L的同分异构体Q是芳香酸,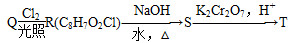 ,T的核磁共振氢谱只有两组峰,Q的结构简式为________,R→S的化学方程式为_______________________________________________________________。
,T的核磁共振氢谱只有两组峰,Q的结构简式为________,R→S的化学方程式为_______________________________________________________________。
(5)上图中,能缩合成体型高分子化合物的酚类单体是_________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第14练有机物的组成、结构和性质练习卷(解析版) 题型:选择题
与CH2=CH2―→CH2Br—CH2Br的变化属于同一反应类型的是( )
A.CH3CHO―→C2H5OH
B.C2H5Cl―→CH2=CH2
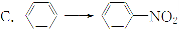
D.CH3COOH―→CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第12练物质制备方案的设计与评价练习卷(解析版) 题型:实验题
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。
(1)请写出乙二酸受热分解的化学方程式______________________。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。

请你按整套装置从左至右的顺序填写下表中的空格:
仪器符号 | 仪器中所加物质 | 装置作用 |
B |
|
|
C |
|
|
C | 氢氧化钠浓溶液 |
|
C |
|
|
D |
|
|
E |
|
|
(3)上述实验中能说明乙二酸受热分解生成了还原性气体的实验现象是________________________________________________________________。
(4)检验乙二酸具有较强的还原性,通常选用的试剂是_______________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习指导预测押题练习卷(二) (解析版) 题型:填空题
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时 减小
减小
E.平衡常数K增大
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
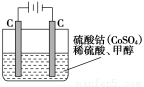
①写出阳极电极反应式_______________;
②写出除去甲醇的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com