
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.黄绿色的氯水光照后颜色变浅
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
D.2NO2(g)![]() N2O4(g)平衡体系中,加压缩小体积后颜色加深
N2O4(g)平衡体系中,加压缩小体积后颜色加深
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
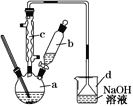
(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜锌原电池中,盐桥中的K+和NO![]() 分别移向负极和正极
分别移向负极和正极
B. SiO2(s)+2C(s)===Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
C. 室温下,将Na2CO3和NaHCO3的混合溶液加水稀释,![]() 减小
减小
D. 电解精炼铜时,若阴极析出3.2 g铜,则阳极失电子数大于6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(Fe3+)=0.1 mol·L-1的溶液中:Na+、Cu2+、Cl-、SCN-
B.使甲基橙变红色的溶液中:K+、Fe2+、Cl-、MnO![]()
C.能与Al反应放出大量H2的溶液中:NH![]() 、Na+、Cl-、HCO
、Na+、Cl-、HCO![]()
D.![]() =10-12的溶液中:Mg2+、Al3+、NO
=10-12的溶液中:Mg2+、Al3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测定某硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)样品纯度的过程为:称取1.5000 g样品,配成100 mL溶液。取0.01mol ·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量的KI。充分反应后,以淀粉作指示剂,用硫代硫酸钠溶液滴定产生的I2,终点时消耗溶液20.00 mL。样品中所含硫代硫酸钠晶体的质量分数为(杂质不参与反应,反应过程中的物质转化关系为K2Cr2O7![]() I2
I2![]() S4O
S4O![]() )
)
A.99.20%B.96.72%C.94.24%D.91.76%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:
![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____。
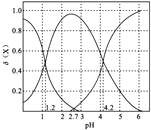
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的电离平衡常数K1=____。
(3)室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.l00 mol·L-1的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化)
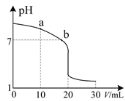
①a点所示的溶液中c(NH3·H2O)____c(Cl-)。
②b点所示的溶液中c(Cl-)____c(NH![]() )。
)。
③pH =10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为____。
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH____。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
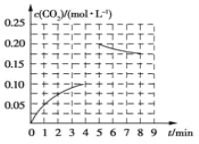
A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究元素周期律性质递变规律,设计如下实验。

实验I:验证碳、氮、硅元素非金属性强弱。(供选择的试剂:稀HNO3、浓H2SO4、CaCO3固体、Na2CO3固体、Na2SiO3溶液、澄清石灰水、饱和NaHCO3溶液)
(1)仪器a的名称:____。装置B所盛试剂是_____,其作用是_____;C中反应的离子方程式是_____________。
(2)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是_____。
实验II:验证同周期元素和同主族元素的金属性递变规律。(方案与现象不对应)
实验方案:①将一小块金属钠放入滴有酚酞试液的冷水中
②将一小块金属钾放入滴有酚酞试液的冷水中
③镁带与2 mol·L-1的盐酸反应
④铝条与2 mol·L-1的盐酸反应
⑤用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞
实验现象: A.浮在水面上,熔成小球,四处游动,随后消失,溶液变成红色
B.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失,溶液变成红色
C.产生气体,可在空气中燃烧,溶液变成浅红色
D.反应不十分剧烈,产生气体可以在空气中燃烧
E.剧烈反应,产生的气体可以在空气中燃烧
请回答:
(1)该实验中用到的玻璃仪器有____、______胶头滴管玻璃片、试管。
(2)请完成下列表格
实验方案 | 实验现象 | 化学方程式 |
① | A | 2Na +2H2O=2NaOH +H2↑ |
② | ____ | ____ |
③ | E | Mg +2HCl=MgCl2 +H2↑ |
④ | D | 2Al +6HC1=2AlCl3 +H2↑ |
⑤ | ____ | ____ |
(3)由实验得出有关元素周期律结论:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com