
【题目】下列关于乙醇的说法不正确的是
A. 与乙醚互为同分异构体 B. 可由乙烯通过加成反应制取
C. 可用纤维素的水解产物制取 D. 通过取代反应可制取乙酸乙酯
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:
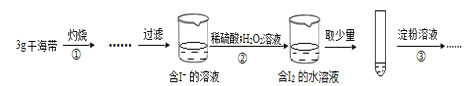
下列说法不正确的是
A. 步骤①需要将干海带放入坩埚中灼烧
B. 步骤②反应的离子方程式为:2I- +2H++H2O2 =I2+2H2O
C. 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D. 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_____种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____,1mol(C2H5O)3P=O分子中含有的σ键的数目为_____。
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
物质 | 氢键X﹣H…Y | 键能kJ.mol﹣1 |
(HF)n | D﹣H…F | 28.1 |
冰 | O﹣H…O | 18.8 |
(NH3)n | N﹣H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因_____。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有_____个,与碳原子等距离最近的碳原子有_____个。已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为_____pm,碳化硅的密度为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铁、废铝是制取氢气、铁盐、铝盐的廉价原料。
Ⅰ. 右图是双钢瓶氢气球机, 它具有安全耐用、 随开随用、随关随停、 气球升力大等优点。

(1)制氢钢瓶内应加入的试剂为_____________.
a.稀硫酸和铁片 b.烧碱溶液和铝片 c.明矾溶液和小苏打溶液 d.盐酸和锌粒
(2)下列物质不能作为干燥室中干燥剂的是_______。
a.浓硫酸 b.碱石灰 c.CaCl2 d.硅藻土
Ⅱ. 欲从 FeSO4溶液中得到绿矾(FeSO47H2O),合理操作是_________(从下列 a~d 中选择, 下同) ; 欲从 NaAlO2溶液中得到 NaAlO2固体,合理操作是____________。
a.加热蒸发至剩余少量水后停止加热, 靠余热把水蒸干; b.减压低温蒸发
c.蒸发浓缩, 冷却结晶, 过滤洗涤; d.加入适量乙醇, 萃取出溶质
Ⅲ. 绿矾高温分解时生成 Fe2O3、SO2、SO3等,为实现该反应并验证各产物,请填写下表。
已知 SO3熔点 16.8℃, 沸点 44.8℃, 下列仪器供挑选。

仪器序号 | 仪器中的试剂 | 仪器中的现象 | 仪器或试剂作用 |
FeSO4·7H2O | 留下红棕色固体 | 实现绿矾的分解, 检出生成物 Fe2O3 | |
CuSO4 | 变蓝 | 检出生成物 H2O | |
— | 有白色粉末聚集 | 检出生成物 SO3 | |
② | 品红溶液 | 褪色 | ____________ |
⑤ | NaOH 溶液 | — | ____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.淀粉和油脂都是天然高分子化合物
B.由乙醇消去制乙烯和乙烯与水反应制乙醇属于同一反应类型
C.由溴乙烷水解制乙醇、乙酸和乙醇制乙酸乙酯属于同一反应类型
D.石油分馏得到乙烯、丙烯、丁二烯等有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序是 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) .
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产、生活中为增大反应速率而采取的措施合理的是
A. 食物放在冰箱中
B. 在食品中添加适量防腐剂
C. 在糕点包装内放置小包除氧剂
D. 工业上燃烧硫铁矿制取SO2时,先将矿石粉碎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.44g BaCl2xH2O配成100mL溶液.25mL此溶液中的Cl﹣恰好能与50mL 0.1molL﹣1的AgNO3溶液完全反应.计算:
(1)此溶液中溶质的物质的量浓度
(2)BaCl2xH2O中的x的值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:

(1)写出制取乙酸乙酯的化学反应方程式_____________________________。
(2)反应中浓硫酸的作用是①___________________;②__________________________。
(3)实验中应缓慢加热,理由是__________________________________________________。
(4)试管II中的导管口为什么要在液面之上? _________________________________________。
(5)饱和的Na2CO3溶液的主要作用是 ______________
(6)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份____________________,如果乙醇含有水份,如何将其转变为无水乙醇__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com