
 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:分析 (1)化学平衡的适用范围是可逆反应,在工业接触法制硫酸2SO2+O2?2SO3为可逆反应,化学平衡移动的条件有:浓度、温度、压强.催化剂V2O5的作用是提高反应速率,温度控制在450℃左右,是根据使催化剂的活性最强确定,压强采用常压.因此根据化学平衡移动原理来确定的条件只有浓度;
(2)结合化学平衡三行计算列式,设反应的氧气浓度为x,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.2 0.2 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.2-2x 0.2-x 2x
在温度和压强不变条件下20分钟后反应达到平衡,SO3体积分数为0.5,$\frac{2x}{0.4-x}$=0.5
x=0.08mol/L
①该温度下,从反应开始至平衡时氧气的平均反应速率=$\frac{△c}{△t}$;
②平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)反应自发进行的判断依据是△H-T△S<0;
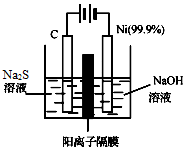
(4)①根据电解池的工作原理:阴极上发生得电子的还原反应,阳极上发生失去电子的氧化反应来回答;
②硫离子具有强的还原性,易被氧气氧化为硫单质,据此来回答.
解答 解:(1)硫酸生产中,第二步:SO3的制取反应原理为:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3,该反应为可逆反应,根据化学平衡原理为了提高SO2的转化率,通常采用增大O2浓度的方法来达到使SO2尽可能多的转化为SO3的目的.
A.矿石加入沸腾炉之前先粉碎,目的是为了增大黄铁矿与空气的接触面,加快4FeS2+11O2 $\frac{\underline{催化剂}}{△}$2Fe2O3+8SO2 反应速率,而不是从2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 反应中化学平衡角度考虑,故A不正确;
B.使用V2O5作催化剂,催化2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 反应,只能加快该反应的速率,不能使平衡移动,故B不正确;
C.接触室中催化转化器使用适宜的温度,目的是使催化剂活性最强,使反应速率最快,而实际上升高温度,会促使2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 平衡向吸热方向移动,即逆向移动,不利于提高SO2的转化率,接触室中不使用很高的温度,故C正确;
D.从沸腾炉中出来的气体成分为SO2、O2、N2,经过净化后,进入接触室,炉气中要有过量的空气,即增大O2浓度,会促使2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3 平衡正向移动,有利于提高SO2的转化率,故D正确;
E.接触室中:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3,增大压强促使平衡正向移动(即气体总体积减小的方向),减小压强促使平衡逆向移动(即气体总体积增大的方向).在常压下,不利于平衡正向移动,不利于提高SO2的转化率.对于该化学平衡,压强的增大,促使平衡正向移动,效果并不明显,所以工业上直接采用常压条件,而不采用高压条件,故E不正确;
故答案为:CD;
(2)结合化学平衡三行计算列式,设反应的氧气浓度为x,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.2 0.2 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.2-2x 0.2-x 2x
在温度和压强不变条件下20分钟后反应达到平衡,SO3体积分数为0.5,$\frac{2x}{0.4-x}$=0.5
x=0.08mol/L
①该温度下,从反应开始至平衡时氧气的平均反应速率=$\frac{0.08mol/L}{20min}$=4×10-3mol/(L•min),
故答案为:4×10-3mol/(L•min);
②该温度下,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数的值K=$\frac{(0.08×2)^{2}}{(0.2-2×0.08)^{2}×(0.2-0.08)}$=106.7,
故答案为:106.7;
(3)工业上冶炼铜主要以黄铜矿(主要成分CuFeS2)为原料,经过多歩反应将铜元素还原为铜.其中有一步为:2Cu2S+3O2(g)═2Cu2O+2SO2.反应△S<0,满足△H-T△S<0,判断此反应的△H<0,
故答案为:<;
(4)①阴极上是阳离子氢离子发生得电子的还原反应,即2H2O+2e-═2OH-+H2↑,当反应转移xmol电子时,产生的气体0.5xmol,体积为0.5xmol×22.4L/mol=11.2xL,
故答案为:2H2O+2e-═2OH-+H2↑; 11.2xL;
②硫化钠中的硫离子具有强的还原性,易被氧气氧化为硫单质,配制时要隔绝氧气,可用氮气气流,即:2S2-+O2+2H2O=2S↓+4OH-,硫化钠溶液中硫离子为多元弱酸阴离子分步水解,溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:2S2-+O2+2H2O=2S↓+4OH-;c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
点评 本题综合考查学生热化学、电化学、化学反应速率和平衡、离子浓度大小比较等方面的知识,注意知识的归纳和整理是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | KCl的电子式: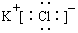 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 中子数为117,质子数为78 的铂原子:${\;}_{117}^{195}Pt$ | |
| D. | K+的结构示意图: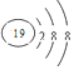 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | NH3•H2O | 小苏打 | 氧化镁 | 二氧化氮 |
| C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
| D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,46 gN2O4中含氧原子数为2NA | |
| B. | 常温常压下,11.2 LNH3中含共价键的数目为1.5NA | |
| C. | 电解精炼铜阳极质量减少32 g时电路中转移电子总数为NA | |
| D. | 1 L 0.2 mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L空气中O2、N2分子总数目为NA | |
| B. | 0.1 mol羟基中所含电子数目为NA | |
| C. | 28 g乙烯、丙烯混合气体中所含原子数为6NA | |
| D. | 5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | - |
| n(CO)/mol | 1.0 | - | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | - | - | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| B. | 铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个 | |
| C. | 常温下,4.4克二氧化碳和二氧化氮中的混合物中氧原子数为0.2NA | |
| D. | 标准状况下,11.2升氯气溶于水,转移电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ②④ | B. | ②④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
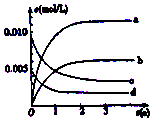 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com