
下列各项中,理由、结论及因果关系均正确的是 ( )
A.由于键能EN≡N> ECl-Cl,故单质的沸点:N2>Cl2
B.由于分子中可电离的H+个数H2SO4> CH3COOH,故两者的酸性:H2SO4>CH3COOH
C.由于元素的非金属性N>P,故氢化物的稳定性:NH3>PH3
D.由于金属性Fe>Cu, 故还原性Fe2+>Cu
科目:高中化学 来源: 题型:
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是( )
A.X、Y、Z、W的原子半径的大小关系为:W > Y > Z > X
B.在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
.下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知
X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼
铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满
状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二
电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、O、Na、Al、S、Cl是常见的元素
(1)C元素位于元素周期表的位置 ;C元素的一种同位素可以测定文物年代,这种同位素的符号为 。
(2)用“>”、“<”或“=”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)黑火药爆炸时发生反应的化学方程式为:S+2KNO3 +3C==K2S +3CO2↑+N2↑反应生成物中,属于非电解质的是_______(写结构式);其中熔点最高的物质的电子式是_________。
(4)在(3)中化学反应方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物①CH2OH(CHOH)4CHO,②CH3CH2CH2OH,③CH2===CH—CH2OH,④CH2===CH—COOCH3,⑤CH2===CH—COOH中,既能发生加成反应、酯化反应,又能发生氧化反应的是( )
A.③⑤ B.②④ C.①③⑤ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
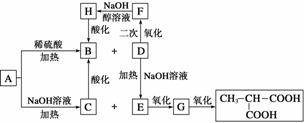
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:______________________________________________________;
②E氧化成G:__________________________________________________________;
③F与氢氧化钠醇溶液共热:______________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)⇋2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com