
【题目】下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
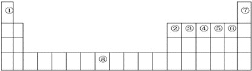
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑦元素位于周期表的__________区。
(2)②、⑥两元素形成的化合物的空间构型为__________,其中心原子的杂化轨道类型为__________。
(3)写出元素⑧基态原子的电子排布式_______________________。
(4)③④⑤⑥四种元素第一电离能的由小到大的顺序为______________(填元素符号)。
(5)与③⑤形成的三原子化合物互为等电子体的分子为__________________。
(6)元素⑧与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于__________晶体(填晶体类型)。
【答案】p 平面正三角形 sp2杂化 ![]() 或
或![]()
![]() CS2或N2O 分子晶体
CS2或N2O 分子晶体
【解析】
由元素在周期表中位置,可知①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为He、⑧为Fe元素。
(1)⑦为He,核外电子排布为1s2;
(2)②、⑥两元素形成的化合物为BF3,计算B原子孤电子对数、价层电子对数,确定空间构型与B原子杂化方式;
(3)元素⑧为Fe,核外电子数为26,根据核外电子排布规律书写基态原子的电子排布式;
(4)一般情况下同一周期的元素,原子序数越大,元素的第一电离能越大。N元素原子2p能级为半满稳定结构,能量较低,第一电离能高于同周期相邻元素;
(5)等电子体是原子个数相同,原子最外层电子数也相同的元素,结合③⑤形成的三原子化合物CO2的分子结构判断;
(6)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体。
由元素在周期表中位置,可知①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为He、⑧为Fe元素。
(1)⑦为He,核外电子排布为1s2,处于周期表中p区;
(2)②、⑥两元素形成的化合物为BF3,B原子孤电子对数为0、价层电子对数3,空间构型为平面正三角形,B原子杂化方式为sp2杂化;
(3)元素⑧为Fe,核外电子数为26,根据核外电子排布规律可得基态原子的电子排布式1s22s22p63s23p63d64s2;
(4)一般情况下同一周期的元素,原子序数越大,元素的第一电离能越大。N元素原子2p能级为半满稳定结构,能量较低,第一电离能高于同周期相邻元素,故③④⑤⑥四种元素第一电离能的由小到大的顺序为C<O<N<F;
(5)③⑤形成的三原子化合物是CO2,最外层电子数是16,由于等电子体是原子个数相同,所以其等电子体可能为CS2或N2O等;
(6)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体。


科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
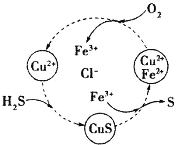
A.在转化过程中化合价不变的元素只有Cu和Cl
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把原子数和电子数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中错误的是( )
A. ![]() 分子各原子均在同一平面上B.
分子各原子均在同一平面上B. ![]() 分子中不存在双键
分子中不存在双键
C. ![]() 和
和![]() 是等电子体,均为三角锥形D.
是等电子体,均为三角锥形D. ![]() 和
和![]() 是等电子体,均为正四面体结构
是等电子体,均为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表_____族。Cu2+的外围电子排布式为_____________。
(2)Cu元素可形成![]() ,其中存在的化学键类型有_____________(填序号)。
,其中存在的化学键类型有_____________(填序号)。
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(3)若![]() 具有对称的空间构型,且当其中的两个NH3被两个Cl取代时,能到两种不同结构的产物,则
具有对称的空间构型,且当其中的两个NH3被两个Cl取代时,能到两种不同结构的产物,则![]() 的空间构型为____________(填字母)。
的空间构型为____________(填字母)。
a.平面正方形 b.正四面体 c.三角锥型 d.V形
(4)在硫酸铜溶液中逐滴滴加氨水至过量,实验现象为先出现蓝色沉淀,最后沉淀溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:______________。
(5)Cu2O的熔点比Cu2S的__________(填“高”或“低”),请解释原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A.分子中3个碳原子在同一直线上
B.分子中所有原子都在同一平面上
C.分子中共价键的夹角均为120°
D.分子中共价键数为8,其中有一个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 螺[2,2]戊烷(![]() )所有碳原子不可能均处于同一平面
)所有碳原子不可能均处于同一平面
B. 酶是一类具有高选择催化性能的蛋白质
C. 氨基酸是两性化合物,能与酸、碱反应生成盐
D. 仅用溴水就可以将酒精、苯酚溶液、己烯、甲苯4种无色液体区分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的容器中,对于反应 A(g)+2B(g)![]() 3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
3C(g)(正反应为吸热反应),下列叙述为平衡状态标志的是
①体系的温度不再变化 ②外界条件不变时,A、B、C浓度保持不变 ③气体平均分子量不再变化 ④体系的压强不再变化 ⑤气体密度不再变化 ⑥3 v正(B)=2 v逆(C) ⑦单位时间内消耗1 mol A(g)的同时生成3 mol C(g)
A.①②⑥B.①②③⑤C.②③④⑤D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com