
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
【答案】B
【解析】分析:由已知的两个热化学方程式,结合温度对化学平衡的影响规律,即可分析A选项,根据自由能判据可分析B选项,利用盖斯定律可分析出C、D两个选项。
详解:A、只有在反应I中生成SO2,且该反应为吸热反应,所以升高温度,有利于反应I平衡向右移动,生成更多的SO2,故A错误;
B、要使反应II自发进行,则自由能判据△G=△H-T△S<0,已知△H2<0,由反应方程式可知该反应的熵变化不大,反应的自发性主要决定于焓变,所以该反应在低温下即可自发进行,且低温有利于节约能源,故B正确;
C、根据盖斯定律,反应II—4×反应I即得C选项的热化学方程式,所以△H3=△H2-4△H1,已知△H1>0,△H2<0,所以△H3<△H2,故C错误;
D、反应I和反应II中没有SO3(g),所以无法通过反应I和反应II计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变,故D错误。所以本题答案选B。
CaO(s)+SO3(g)的焓变,故D错误。所以本题答案选B。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向[H+]=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中[H+]=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A. 该温度高于25 ℃
B. 所得溶液中,由水电离出来的H+的浓度为1×10-11mol·L-1
C. 加入NaHSO4晶体抑制水的电离
D. 该温度下,此NaHSO4溶液与某pH=11的Ba(OH)2溶液混合后溶液呈中性,则消耗的NaHSO4溶液与Ba(OH)2溶液的体积比为100:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某碳酸钠和碳酸氢钠的混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。
(1)求混合物中碳酸钠的质量分数?
(2)标准状况下生成CO2气体的体积?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从含镍电镀废渣(除含镍外,还含有Cu、Zn、Fe等杂质)中制备NiCO3的工艺流程如下。

(1)“酸化”时需将电镀废渣粉碎并适当加热,原因是________________________。
(2)“氧化”时需要控制温度不超过40℃,其目的是________________________;“沉铁”后所得滤液中c(Fe3+)=____________mol·L-1[该温度下 Fe(OH))3的Ksp=2.64×10-39]。
(3)Fe2+也可以用NaCO3氧化,一定条件下可生成黄铁矾钠[Na2Fe6(SO4) 4(OH)12沉淀而被除去;如图是pH-温度关系图,图中阴影部分为黄铁矾钠稳定存在区域。

①FeOOH中铁的化合价是____________价。.
②酸性条件下,ClO3ˉ恰好氧化Fe2+时,氧化剂与还原剂物质的量之比是____________。
③根据上图,当T=120℃、pH=4时Fe元素的存在形式是____________(填化学式),该温度下,若要制得黄铁矾钠需控制pH范围____________(填字母选项)。
a.0~1 b.1~2.5 c.2.5~4
(4)已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NCl2的化学方程式____________________________________。NCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F(![]() )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下:

已知

(1)写出B的官能团名称___________。
(2)下列有关物质C的说法正确的是________。
a.C的分子式是C9H12O3 b.C的核磁共振氢谱共有4组吸收峰
c.1mlC最多消耗1mol金属Na d.C可以发生取代、加成和消去反应
(3)写出①的化学方程式:____________________________________。
(4)E的结构简式为________________________________________________。
(5) 有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
①1mol该物质最多消耗3 mol NaOH; ②苯环上一氯代物只有两种。
(6)参照上述合成路线,设计由乙烯合成2-丁醇的合成路线。(用合成路线流程图表示,并注明反应条件,合过程中只有无机试剂可任选) ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+![]() Fe3+。在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
Fe3+。在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
(2)“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作_____剂,具____性。
(3)已知下列反应在一定条件下发生:

在以上的反应中,Fe2+实际上起着 ______________的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
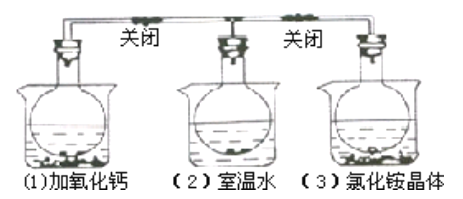
A. 2NO2![]() N2O4是放热反应
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则V2为

A.240mL B.300mL C.400mL D.440mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com