
| A. | 萘(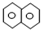 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 酚酞的结构如图所示,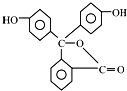 其结构中含有羟基(-OH),故酚酞属于醇 其结构中含有羟基(-OH),故酚酞属于醇 | |
| C. | 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来 | |
| D. | 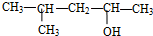 的名称为2-甲基-4-戊醇 的名称为2-甲基-4-戊醇 |
分析 A.萘与足量氢气充分加成的产物为 ,由结构对称性可知,含3种位置的H,如图
,由结构对称性可知,含3种位置的H,如图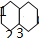 ;
;
B.含酚-OH和-COOC-;
C.甲苯、己烯、CCl4、乙醇分别与溴水混合的现象为:分层后有机层在上层、溴水褪色、分层后有机层在下层、不分层;
D.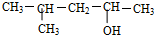 中主链含5个C,-OH在2号碳上,甲基在4号C上.
中主链含5个C,-OH在2号碳上,甲基在4号C上.
解答 解:A.萘与足量氢气充分加成的产物为 ,由结构对称性可知,含3种位置的H,如图
,由结构对称性可知,含3种位置的H,如图 ,则一氯代物有3种,故A错误;
,则一氯代物有3种,故A错误;
B.含酚-OH和-COOC-,该物质为酚或酯类,故B错误;
C.甲苯、己烯、CCl4、乙醇分别与溴水混合的现象为:分层后有机层在上层、溴水褪色、分层后有机层在下层、不分层,现象不同,可鉴别,故C正确;
D.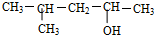 中主链含5个C,-OH在2号碳上,甲基在4号C上,名称为4-甲基-2-戊醇,故D错误;
中主链含5个C,-OH在2号碳上,甲基在4号C上,名称为4-甲基-2-戊醇,故D错误;
故选C.
点评 本题考查较综合,涉及有机物的鉴别、有机物的结构与性质、同分异构体及命名等,注重高频考点的考查,注意把握官能团与性质的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 标签上给出的离子的物理量是物质的量浓度 | |
| B. | 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之内 | |
| C. | 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L | |
| D. | 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过1×10-5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
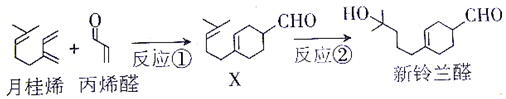
| A. | 反应①属于加成反应 | |
| B. | 新铃兰醛能发生消去反应 | |
| C. | 检验新铃兰醛中是否混有醛X,可用溴水 | |
| D. | 1mol新铃兰醛完全燃烧需消耗17.5mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
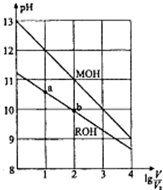 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,| A. | MOH的碱性弱于ROH的碱性 | |
| B. | ROH的电离平衡常数:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)不相等 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O (l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+1/2O2(g)═H2O (l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质都是天然高分子化合物 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| D. | 用大米酿的酒在一定条件下密封保存,时间越长越香醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加入足量的盐酸 CO32-+2H+═CO2↑+H2O | |
| B. | 单质铁和三氯化铁溶液反应生成氯化亚铁 Fe+Fe3+═2Fe2+ | |
| C. | 金属钠与水反应生成氢氧化钠和氢气Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铵晶体和石灰粉共热产生氨气 NH4++OH-═NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com