
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量的变化趋势,错误的是

科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高一上期中化学试卷(解析版) 题型:选择题
下列对于“摩尔”的说法和理解正确的是
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
D.摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏高邮市高一上学期期中调研测试化学试卷(解析版) 题型:选择题
若某氖原子的质量是a g,一个12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
A.该氖原子的相对原子质量可以表示为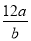
B.该氖原子的相对原子质量可以表示为aNA
C.W g该氖原子的物质的量一定是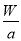 mol
mol
D.12b=NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为: H2SO4=H++HSO4-,HSO4- H++SO42-。.
H++SO42-。.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)。
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>”“=”或“<”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
①已知BaSO4的Ksp=C(Ba2+)·C(SO42-),所以在硫酸钡溶液中有C(Ba2+)=C(SO42-)=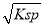 mol/L;
mol/L;
②常温下,强酸溶液的PH=a,将溶液的体积稀释到原来的10n倍,则PH=a+n;
③将0.1mol/L的NaHS和0.1mol/L的Na2S溶液等体积混合,所得溶液中有C(S2-)+2C(OH-)=2C(H+)+C(HS-)+3C(H2S);
④在0.1mol/L氨水中滴加0.1mol/L盐酸,恰好中和时PH=a,则由水电离产生的C(OH-)=10-amol/L
A.①④ B.②③ C.③④ D.①②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是
A.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7;SO42- + 2H+ + Ba2+ + 2OH- = BaSO4↓ + 2H2O
B.明矾水解的离子方程式: Al3++3 H2O Al(OH)3 +3H+
Al(OH)3 +3H+
C.Mg(HCO3)2 溶液与盐酸溶液反应的离子方程式:HCO3-+ H+ == CO2↑+H2O
D.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu +O2↑+4H+
2Cu +O2↑+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期月考化学试卷(解析版) 题型:计算题
(7分)实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为_________,参加反应的HCl有______mol。(4分)
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度 。(3分)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期月考化学试卷(解析版) 题型:选择题
30 mL 1 mol/L NaCl溶液和40 mL 0.5 mol/L CaCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为
A.0.5 mol/L B.0.6 mol/L C.1 mol/L D.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高二上学期月考化学试卷(解析版) 题型:选择题
下列有关乙醇的物理性质的应用中不正确的是:
A.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
B.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com