
分析 (1)发生的反应为:CH4+4CuO=CO2↑+2H2O↑+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻4.8g,可知减少的质量为氧元素的质量,利用差量法计算甲烷的物质的量,根据V=nVm计算甲烷的体积;
(2)若二氧化碳全部转化为CaCO3,生成10g沉淀是CaCO3,根据n=$\frac{m}{M}$计算碳酸钙的物质的量,可知反应后的二氧化碳总的物质的量;若二氧化碳部分转化为CaCO3,生成10g沉淀是CaCO3,根据钙离子守恒可知转化生成的Ca(HCO3)2的物质的量,再根据碳元素守恒计算反应后的二氧化碳总的物质的量;
(3)若二氧化碳全部转化为CaCO3,生成10g沉淀是CaCO3,根据n=$\frac{m}{M}$计算碳酸钙的物质的量,可知反应后的二氧化碳总的物质的量,根据甲烷的物质的量计算反应生成的二氧化碳的物质的量,进而计算原混合气体中二氧化碳的物质的量,再计算原混合物中CO2的体积,进而计算氮气的体积;
若二氧化碳部分转化为CaCO3,生成10g沉淀是CaCO3,根据钙离子守恒可知转化生成的Ca(HCO3)2的物质的量,再根据碳元素守恒计算反应后的二氧化碳总的物质的量,减去反应生成的二氧化碳的物质的量即为原混合气体中二氧化碳的物质的量,计算二氧化碳体积,进而计算氮气的体积.
解答 解:(1)设甲烷的物质的量为x,当甲烷完全反应后,硬质玻璃管的质量减轻4.8g,则:
CH4+4CuO=CO2+2H2O+4Cu 质量减轻△m
1mol 16×4g
x 4.8g,
解得:x=$\frac{4.8g×1mol}{64g}$=0.075mol,
原混合气体中甲烷的物质的量为0.075mol,标况下的体积为:0.075mol×22.4L/mol=1.68L,
答:CH4+4CuO=CO2+2H2O+4Cu 质量减轻△m
1mol 16×4g
x 4.8g,
解得:x=$\frac{4.8g×1mol}{64g}$=0.075mol,
原混合气体中甲烷的物质的量为0.075mol,标况下的体积为:0.075mol×22.4L/mol=1.68L;
(2)若二氧化碳全部转化为CaCO3,生成10g沉淀是CaCO3,碳酸钙的物质的量为:$\frac{10g}{100g/mol}$=0.1mol,故反应后的二氧化碳总的物质的量为0.1mol;若二氧化碳部分转化为CaCO3,生成10g沉淀是CaCO3,物质的量为0.1mol,根据钙离子守恒可知转化生成的Ca(HCO3)2的物质的量为:2L×0.1mol/L-0.1mol=0.1mol,故反应后的二氧化碳总的物质的量为0.1mol+0.1mol×2=0.3mol,故答案为:0.1mol或0.3mol;
(3)若二氧化碳全部转化为CaCO3,生成10g沉淀是CaCO3,碳酸钙的物质的量为:$\frac{10g}{100g/mol}$=0.1mol,故反应后的二氧化碳总的物质的量为0.1mol,甲烷反应生成的二氧化碳的物质的量为0.075mol,故原混合气体中二氧化碳的物质的量为0.1mol-0.075mol=0.025mol,原混合物中CO2的体积为0.025mol×22.4L/mol=0.56L,故原混合气体中氮气的体积为:8.96L-1.68L-0.56L=6.72L,
若二氧化碳部分转化为CaCO3,生成10g沉淀是CaCO3,物质的量为0.1mol,根据钙离子守恒可知转化生成的Ca(HCO3)2的物质的量为:2L×0.1mol/L-0.1mol=0.1mol,故反应后的二氧化碳总的物质的量为0.1mol+0.1mol×2=0.3mol,甲烷反应生成的二氧化碳的物质的量为0.075mol,故原混合气体中二氧化碳的物质的量0.3mol-0.075mol=0.225mol,原混合物中CO2的体积为0.225mol×22.4L/mol=5.04L,故原混合气体中氮气的体积为:8.96L-1.68L-5.04L=2.24L,
故答案为:2.24L或6.72L.
点评 本题考查了混合物的有关计算,题目难度中等,注意掌握有关混合物反应的计算方法,注意(3)中反应后的二氧化碳不一定完全转化碳酸钙沉淀,可能生成碳酸氢钙,据此讨论计算.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
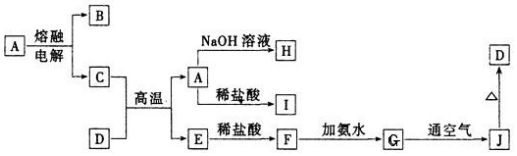
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
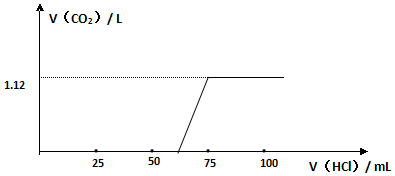
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | 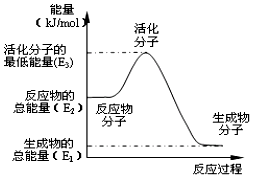 反应①中的能量变化如图所示,且△H1=E2-E1 | |
| C. | 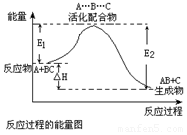 反应②中的能量变化如图所示,且△H2=E2-E1 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | NH4+-气体法 | B. | I--沉淀法 | ||
| C. | Na+-显色法 | D. | CO32--气体法和沉淀法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.16mol/L | C. | 0.08mol/L | D. | 0.04mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com