
| A、第四周期ⅡA族 |
| B、第三周期ⅣA族 |
| C、第三周期ⅥA族 |
| D、第二周期ⅣA族 |
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、饱和NaCl溶液 |
| B、稀NaHSO4溶液 |
| C、MgCl2溶液 |
| D、CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、正、逆反应速率的比值是恒定的 |
| C、当HI的分子数与I2分子数之比为2:1时,说明反应达到了平衡状态 |
| D、达到平衡时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
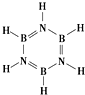 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:
将一定量的NaOH、NaHCO3和Na2CO3三种溶液混合,向混合液中逐渐滴滴加一定浓度的稀盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:


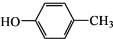 和CH3COOH为原料制备
和CH3COOH为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com