
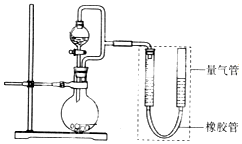
 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.| 实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
分析 (1)根据装置e为球形漏斗结合实验产物性质分析;
(2)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;
(3)乙醛中具有还原性的醛基,被新制的银氨溶液氧化;
(4)①对比实验1和实验2,反应条件只有温度不同,故其实验目的是:比较温度不同对银镜反应的影响;
②其它条件相同,随着温度升高,反应速率加快:其它条件相同,温度为55℃的反应速率应该在温度为45℃温度为65℃之间;
(5)试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明存在酸性有机物,再乙醛的氧化产物为乙酸进行分析即可;欲除去此酸性物质,应结合酸的通性分析,选择试剂,另外再根据相互混溶的液体混合物的常见分离方式,选择分离操作.
解答 解:(1)D为乙醛,易溶于水,装置e为球形漏斗,球形部分体积大,能防止倒吸,同时冷凝收集产品,
故答案为:冷凝收集产品,并防止倒吸;
(2)乙醇的催化氧化反应过程:金属铜被氧气氧化为氧化铜,2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO,氧化铜将乙醇氧化为乙醛,CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O,
故答案为:2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O;
(3)醛基能被弱氧化剂氧化为羧基,用银氨溶液检验D中官能团的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(4)①对比实验1和实验2的反应条件,其它条件相同,只有温度不同,其实验目的是比较银镜反应中,温度不同对生成银镜的影响;
故答案为:温度对反应速率的影响;
②由实验1和实验2知:银氨溶液的量为1mL,乙醛的量为3滴,反应混合液pH为11时,水浴温度为45℃,出现银镜时间为6.5min,水浴温度为65℃,出现银镜时间为5min,其它条件相同,随着温度升高,反应速率加快,故:当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为55℃,反应混合液pH为11时,出现银镜的时间应在5min到6.5min之间,
故答案为:5~6.5;
(5)若试管中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏.
点评 本题考查乙醇的化学性质、混合物的分离与提纯等,题目难度中等,注意掌握物质性质和实验基本操作方法是解题本题关键,明确乙醇的催化氧化原理,侧重于化学方程式的书写、乙醛进行银镜反应的最佳实验条件探究,注意银镜反应实验成功的关键因素.


科目:高中化学 来源: 题型:解答题
 在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).
在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z最外层电子数之和为20 | B. | WX2、YX2和ZX2均只含共价键 | ||
| C. | 原子半径的大小顺序为X<W<Y<Z | D. | Z的气态氢化物比Y的稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水、氯化铁溶液 | B. | 溴水、酸性高锰酸钾溶液 | ||
| C. | 氯化铁溶液、碳酸钠溶液 | D. | 氯化铁溶液、酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
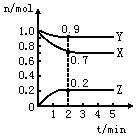 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的反应物总能量比产物总能量低QkJ | |
| B. | 1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 | |
| C. | 在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
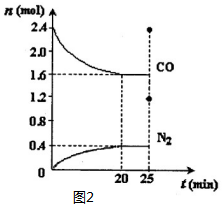 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.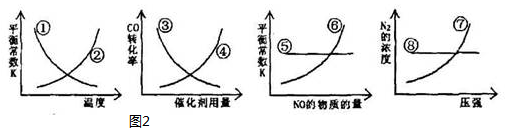
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com