
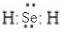 .
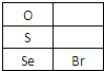
.| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | SeO2+2SO2+2H2O═Se+2H2SO4 |
| 2 | 还原性 | SeO2+2H2O2=H2SeO4+2H2O |
| 3 | 酸性氧化物 | SeO2+NaOH=Na2SeO3+H2O |
分析 (1)金属性越强,其对应最高价氧化物水化物的碱性越强;
(2)同主族,最外层电子数相同,性质相似,从上到下金属性增强;
(3)①Br处于第四周期第VIIA族,Se原子序数比Br小1,据此解答即可;
②为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-Se键;
③同一主族,原子序数越大,非金属性越弱,同一周期,原子序数越大,非金属性越强,从氢化物的稳定性强弱可以得出非金属性强弱;
④类比二氧化硫的性质回答即可,二氧化硫具有氧化性、还原性和酸性氧化物的性质.
解答 解:(1)由题给信息可知,Na与水反应剧烈,Mg与Li反应不剧烈,Mg与Li均形成中强碱,NaOH为强碱,且Mg与Li只生成氧化物,Na形成过氧化物,据此判断金属性:Na>Mg=Li,故答案为:Na>Mg=Li;
(2)金属性Sr<Ba,则碱性:Sr(OH)2<Ba(OH)2,锶的化学性质与钙和钡类似,是因同一主族元素,原子最外层电子数相同,
故答案为:<; 锶和钡位于同一主族,锶的电子层数比钡少,原子半径小,失电子能力弱,金属性弱;
(3)①Br处于第四周期第VIIA族,Se原子序数比Br小1,故处于第四周期第VIA族,故答案为:第四周期第VIA族;
②H2Se为共价化合物,硒原子中最外层有8个电子达到稳定结构,分子中存在两个H-Se键,电子式为: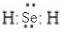 ,故答案为:
,故答案为: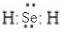 ;
;
③同一主族,原子序数越大,非金属性越弱,同一周期,原子序数越大,非金属性越强,故非极性性:Cl>Br>Se,氢化物的稳定性可以说明此点,即氢化物稳定性顺序为:HCl>HBr>HSe,故答案为:Cl>Br>Se;氢化物的稳定性;
④SeO2与SO2性质类似,二氧化硫具有氧化性、还原性和酸性氧化物的性质,故SeO2也具有这些性质,发生反应分别为SeO2+2H2O2=H2SeO4+2H2O、SeO2+NaOH=Na2SeO3+H2O,
故答案为:还原性;SeO2+2H2O2=H2SeO4+2H2O;酸性氧化物;SeO2+NaOH=Na2SeO3+H2O.
点评 本题考查元素周期律及其应用,学生熟悉元素的金属性与非金属性的递变规律是解答本题的关键,难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 正极附近的 SO42- 离子浓度逐渐增大 | |
| B. | 电流由锌片流向铜片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上析出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
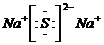 ,①的最高价氧化物的电子式为
,①的最高价氧化物的电子式为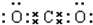 .
. ,其最高价氧化物形成的晶体类型为原子晶体.
,其最高价氧化物形成的晶体类型为原子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯、金刚石都属于单质 | B. | 漂白粉、CuSO4•5H2O都属于混合物 | ||
| C. | 次氯酸、氨气都属于电解质 | D. | 蛋白质、油脂都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | ${\;}_{\;}^{12}$C和${\;}_{\;}^{14}$C是碳元素的两种同素异形体 | |
| C. | 该反应中化学能全部转化为热能 | |
| D. | 在该反应条件下,C的还原性强于Mg的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可获得石油气、汽油、苯及其同系物等 | |
| B. | 石油催化裂化主要得到乙烯、乙炔等 | |
| C. | 煤含有苯和甲苯,可干馏后获得苯和甲苯 | |
| D. | 煤的液化、气化属于均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为NH3,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是NaOH | ||
| C. | 若甲为NaOH溶液,则丁可能是CO2 | D. | 若甲为SiO2,则丁可能是C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com