
| Ԫ�� | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| �縺�� | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����и�����Ũ��Ϊ��c��Na+����c��HCO3-����c��OH-����c��H+�� | ||||||
B���������¶ȣ�
| ||||||
| C���ۼ���������ˮϡ�ͣ�����ƽ�������ƶ���c��H+������ | ||||||
| D���ۺܵ͢������Ϻ���Һ��pH��7����c��Na+����c��CH3COO-����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
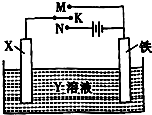 ��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g����H=akJ?mol-1
��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g����H=akJ?mol-1| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na2BeO2��Һ��pH��7���������ɲ����պ�õ��IJ�����ΪBeO |
| B��BeCl2��Һ��pH��7���������ɲ����պ�õ��IJ����������BeCl2 |
| C��Be��OH��2�����������ᣬ��������NaOH��Һ |
| D��BeCl2ˮ��Һ�ĵ�����ǿ����BeCl2�����ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��PM2.5�ڿ������γ������ܽ� |
| B��ͬ��ͬѹ�����£��������������ͳ��������Ϊ2��3 |
| C��16g�����к���NA��ԭ�� |
| D��1.00 mol�����к��е�������Ϊ18NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ӱ뾶������������ |
| B�����ʵĻ�ԭ�ԣ����������� |
| C���ס��ҡ������������ֻ��һ�� |
| D���ҡ�������������������Ӧ��ˮ���������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��500mL 2mol?L-1 ��������Һ������������ΪNA |
| B��0.1mol?L-1Na2CO3��Һ�е���������������0.1NA |
| C����⾫��ͭʱ����������������64g�������·�����ϲ�һ��ͨ��2 NA������ |
| D����״���£�22.4L NO��11.2L O2��Ϻ�����ķ�������Ϊ1.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.05mol/L |
| B��0.001mol/L |
| C��0.002mol/L |
| D��0.005mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com