
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ------------- |
| 步骤2: 向A试管中加入1-2mL 0.0lmol•L-1 KMnO4溶液,振荡试管 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3: 向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
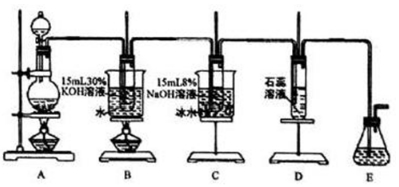
分析 制取氯酸钾、次氯酸钠和氯水:A装置二氧化锰和浓盐酸来制取氯气,该反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B装置:氯气与热的KOH溶液发生反应3Cl2+6KOH(浓)$\frac{\underline{\;\;△\;\;}}{\;}$5KCl+KClO3+3H2O,产生氯酸钾和氯化钾及水,C装置:氯气和氢氧化钠溶液发生反应:Cl2+2KOH=NaCl+NaClO+H2O,氯气通入D装置的 石蕊试液,溶液先变红后褪色,最后变黄绿色,尾气用刚吸收过少量SO2的NaOH溶液吸收,
(1)实验室用二氧化锰和浓盐酸共热制备氯气;
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、漏斗、玻璃棒;制备的氯气含有氯化氢,所以为提高氯酸钾和次氯酸钠的产率,在A和B之间添加盛有饱和NaCl的洗气装置;
(3)温度较高时生成氯酸盐;
(4)装置D中为石蕊试液,通入氯气,部分氯气生成盐酸和次氯酸,显酸性,石蕊显红色,次氯酸漂白性,红色褪去,最终形成氯水溶液,呈现黄绿色;
(5)①用刚吸收过少量SO2的NaOH溶液吸收氯气,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-,可能假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO-;假设 3:只存在ClO;
②根据所限制实验试剂和SO32-、ClO-的性质,先加入硫酸至酸性,若存在SO32-、ClO-,分别生成了H2SO3和HClO;因为HClO具有氧化性,选择淀粉 KI 溶液,证明有ClO-的存在;
H2SO3具有还原性,选择具有强氧化性高锰酸钾溶液,证明SO32-的存在.
解答 解:(1)实验室用二氧化锰和浓盐酸共热制备氯气,反应为:Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、漏斗、玻璃棒;制备的氯气含有氯化氢,所以为提高氯酸钾和次氯酸钠的产率,在A和B之间添加盛有饱和NaCl的洗气装置;
故答案为:漏斗、玻璃棒;在A和B之间添加盛有饱和NaCl的洗气装置;
(3)温度较高时生成氯酸盐,C装置制备次氯酸钠,故用冷水浴;
故答案我:温度升高会生成氯酸钠;
(4)装置D中为石蕊试液,通入氯气,部分氯气生成盐酸和次氯酸,显酸性,石蕊显红色,次氯酸漂白性,红色褪去,最终形成氯水溶液,呈现黄绿色;
故答案为:黄绿色;
(5)①用刚吸收过少量SO2的NaOH溶液吸收氯气,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-,SO32-具有还原性,ClO-具有氧化性,二者不能共存,可能假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO-;假设 3:只存在ClO;
故答案为:只存在ClO;
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO,H2SO3的还原性能使酸性高锰酸钾褪色,HClO的氧化性能氧化碘离子为碘单质,使淀粉显蓝色,故具体步骤和结论为:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ---------- |
| 步骤2:向A试管中滴入1-2mL0.01mol/L 酸性 KMnO4 溶液 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3:向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
| 实验步骤 | 预期现象和结论 |
| --------- | |
| 步骤2:向A试管中滴入1-2mL0.01mol/L 酸性 KMnO4 溶液 | |
| 步骤3:向B试管中滴加1-2滴淀粉-KI溶液 |
点评 本题属于物质制备和实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,注意对物质基本性质的掌握并加以灵活运用,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO 3- NO 3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在SO42-、SO32-、NH4+,可能存在Na+ | |
| B. | 一定存在SO42-、SO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 溶液中可能含有Cl-,且Na+浓度至少为0.15mol•L-1 | |
| D. | c(SO42-)=0.1mol•L-1,c(NH4+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
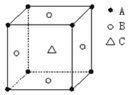 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )| A. | 1:2:1 | B. | 1:3:1 | C. | 2:2:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com