
A.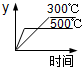 | B.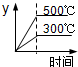 | C.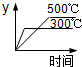 | D.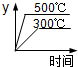 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
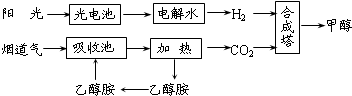
| 催化剂 |
| 投料比[n(H2)/n(CO2)] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
C2H2(g)+2Q2和2C(s)+2H2(g)ƒC2H4(g)+2Q3中Q1、Q2、Q3的值大小比较是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q2>Q3>Q1 D.Q3>Q2>Q1
查看答案和解析>>
科目:高中化学 来源: 题型:013
对于平衡①C2H2+H2ƒC2H4和平衡②2CH4ƒC2H4+2H2,在其他条件不变时,温度降低,①式向右移动,②式向左移动,则热化学方程式C(s)+2H2(g)ƒCH4+Q1,2C(s)+H2(g)ƒ
C2H2(g)+2Q2和2C(s)+2H2(g)ƒC2H4(g)+2Q3中Q1、Q2、Q3的值大小比较是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q2>Q3>Q1 D.Q3>Q2>Q1
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于平衡①C2H2+H2?C2H4和平衡,②2CH4?C2H4+2H2,在其他条件不变时,温度降低,①式向右移动,②式向左移动,
则热化学方程式C(s)+2H2(g)?CH4+Q1,2C(s)+H2(g)?C2H2(g)+2Q2和2C(s)+2H2(g)?C2H4(g)+2Q3中Q1、Q2、Q3的值大小比较是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com