
【题目】根据下列物质的转化关系,回答问题:
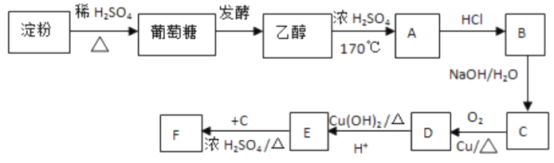
(I)淀粉属于___。
A.多糖 B.酯类 C.高分子化合物 D.单糖
(2)葡萄糖常用于水壶胆镀银,说明它有___(写出官能团名称);
(3)完成下列方程式:C6H12O6![]() 2C2H5OH+2___
2C2H5OH+2___
(4)写出B的结构简式:___;
(5)写出下列化学方程式:
①C→D:___;
②E+C→F:___。
【答案】AC 醛基 CO2 CH3CH2Cl 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH2OH+CH3COOH
2CH3CHO+2H2O CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】
根据题中各物质转化关系,淀粉在酸性条件下水解得葡萄糖,葡萄糖发酵生成乙醇,乙醇在浓硫酸作用下加热得A为CH2=CH2,与氯化氢发生加成得B为CH3CH2Cl,CH3CH2Cl碱性水解得C为CH3CH2OH,CH3CH2OH发生氧化反应得D为CH3CHO,进一步被氧化成E为CH3COOH,与C发生酯化反应得F为CH3COOCH2CH3。
⑴淀粉属于多糖,是高分子化合物,故答案为:AC。
⑵葡萄糖常用于水壶胆镀银,说明它有还原性基团醛基;故答案为:醛基。
⑶根据元素守恒可完成下列方程式:C6H12O6![]() 2C2H5OH+2CO2↑,故答案为:CO2。
2C2H5OH+2CO2↑,故答案为:CO2。
⑷根据上面的分析可知,B的结构简式为:CH3CH2Cl,故答案为:CH3CH2Cl。
⑸①C→D的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
②E+C→F的化学方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是
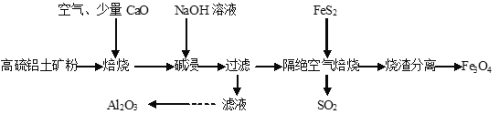
A.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B.向滤液中通入过量HCl气体、过滤、洗涤、灼烧沉淀可制得Al2O3
C.隔绝空气焙烧时理论上反应消耗的n(FeS2):n(Fe2O3)=1:5
D.烧渣分离可用磁选法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家们研究开发了一种柔性手机电池,示意图如图所示[其中多硫化锂(Li2Sx)中x=2、4、6、8]。下列说法错误的是
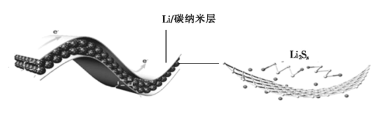
A.碳纳米层具有导电性,可用作电极材料
B.放电时,Li+移向Li2Sx膜
C.电池工作时,正极可能发生反应:2Li2S6+2Li++2e-=3Li2S4
D.电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为1L的密闭容器中充入2mol A和1![]() B,发生如下反应:
B,发生如下反应:![]() ,5min后反应达到平衡,这时C的浓度为1.2
,5min后反应达到平衡,这时C的浓度为1.2![]() ,请回答:
,请回答:
(1)5min内A消耗速率![]() ________________________________;
________________________________;
(2)能判断该反应达到化学平衡状态的依据是__________________;
A.混合气体的压强保持不变 B.单位时间内生成2molA的同时生成1mol B
C.混合气体的密度保持不变 D.A、B、C的物质的量之比为![]()
(3)该反应的平衡常数表达为K=_______________________,该温度下反应的平衡常数是_________;
(4)B在此条件下的转化率为___________________;
(5)升高温度,混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X、Y、Z的分子式都是C7H8O,当它们处于液体状态时,分别滴入到FeCl3溶液,只有Z呈紫色,若投入金属钠,只有Y无现象,下列说法不正确的是( )
A.Z的官能团名称为羟基
B.X属于醇类
C.Y没有同类物质的同分异构体
D.Z的结构简式只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质之间通过一步反应不能实现如图所示转化的是( )
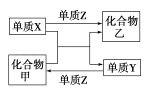
选项 | X | Y | Z | 甲 | 乙 |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制含碳、氮、硫的化合物等大气污染物对打造宜居环境具有重要意义。
(1)已知反应![]() 的
的![]() 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收![]() 的能量,则
的能量,则![]() 分子中化学键断裂时需要吸收的能量为______kJ。
分子中化学键断裂时需要吸收的能量为______kJ。
(2)用![]() 消除
消除![]() 污染的反应原理如下:
污染的反应原理如下:![]() ,不同温度条件下,
,不同温度条件下,![]() 与NO的物质的量之比分别为
与NO的物质的量之比分别为![]() 时,得到
时,得到![]() 脱除率曲线如图所示:
脱除率曲线如图所示:
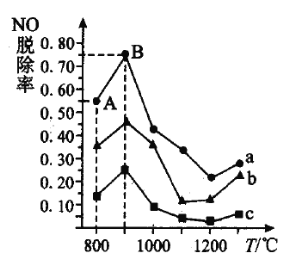
曲线![]() 对应
对应![]() 与
与![]() 的物质的量之比是_______。
的物质的量之比是_______。
②曲线![]() 中
中![]() 的起始浓度为
的起始浓度为![]() ,从
,从![]() 点到
点到![]() 点经过
点经过![]() ,该时间段内
,该时间段内![]() 的脱除速率为_________________
的脱除速率为_________________![]() 。
。
(3)已知常温下电离平衡常数:![]() 的
的![]() 的
的![]() 。
。
①溶液中下列微粒可以大量共存的是___________(填字母)。
a.![]() b.
b.![]() c.
c.![]()
②常温下,某种碳酸钠与碳酸氢钠混合溶液的![]() ,则
,则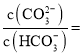 _____________。
_____________。
(4)利用电解法处理高温空气中稀薄的![]() (
(![]() 浓度约为
浓度约为![]() 的10倍),装置示意图如图所示,固体电解质可传导
的10倍),装置示意图如图所示,固体电解质可传导![]() 。
。
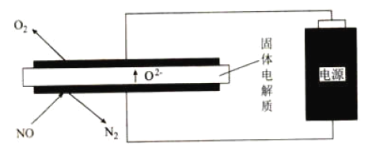
①阴极的电极反应式为_______________。
②消除一定量的![]() 所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)__________。
所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com