
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.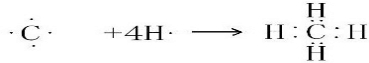 .
.分析 根据元素在周期表中位置知,元素①~⑨分别是H、C、O、F、Na、Al、Si、P、Cl元素,
(1)ⅠA族元素的金属性大于同一周期元素,且原子序数越大,金属性越强;ⅤⅡA族元素非金属性在同一周期中最强,且原子序数越小,非金属性越强,据此进行判断;⑨为Cl元素,其原子序数为17,核外电子层数为3、最外层为7个电子,据此画出氯原子的结构简示意图;
(2)①与②可形成共价化合物为二氧化碳,二氧化碳为共价化合物,用电子式表示出二氧化碳的形成过程;
(3))⑤、⑥、⑦分别为Na、Al、Si,电子层相同时,核电荷数越大,原子半径越小;
(4)非金属性越强,对应氢化物越稳定;
⑦、⑧、⑨分别为Si、P、Cl,非金属性越强,对应氢化物越稳定,据此判断三种元素的气态氢化物的稳定由强到弱;
(5)元素⑨的单质为氯气,氯气与溴化钠反应生成氯化钠和溴,据此写出反应的离子方程式.
解答 解:根据元素在周期表中位置知,元素①~⑨分别是H、C、O、F、Na、Al、Si、P、Cl元素,
(1)ⅠA族元素的金属性大于同一周期元素,且原子序数越大,金属性越强,所以在标号元素中,最活泼的金属元素名称是钠;
ⅤⅡA族元素非金属性在同一周期中最强,且原子序数越小,非金属性越强,则最活泼的非金属元素名称是氟;
⑨为Cl元素,其原子序数为17,最外层为7个电子,氯原子的结构简示意图为: ,
,
故答案为:钠;氟; ;
;
(2)①与②可形成共价化合物为甲烷,用电子式表示①与②形成共价化合物的形成过程为: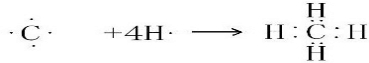 ,
,
故答案为: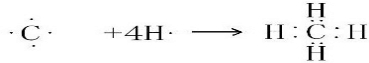 ;
;
(3))⑤、⑥、⑦分别为Na、Al、Si,电子层相同时,核电荷数越大,原子半径越小,则三种元素的原子半径由大到小的顺序为:⑤>⑥>⑦,
故答案为:⑤>⑥>⑦;
(4)非金属性越强,对应氢化物越稳定,则①~⑨元素所形成的气态氢化物最稳定的为HF;
⑦、⑧、⑨分别为Si、P、Cl,非金属性越强,对应氢化物越稳定,三种元素的气态氢化物的稳定由强到弱的顺序为:HCl>PH3>SiH4,
故答案为:HF;HCl>PH3>SiH4;
(5)元素⑨的单质为氯气,氯气与溴化钠反应生成氯化钠和溴,反应的离子方程式为:2Br-+Cl2=2Cl-+Br2,
故答案为:2Br-+Cl2=2Cl-+Br2.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,注意掌握元素周期律内容、元素周期表结构,明确常见化学用语的概念及书写原则,试题侧重考查学生的、理解能力.


科目:高中化学 来源: 题型:选择题

| A. | 操作①用到的玻璃仪器有:烧杯、玻璃棒、漏斗 | |
| B. | 操作②中需加入氧化剂 | |
| C. | 可以用四氯化碳或酒精代替苯作萃取剂 | |
| D. | 蒸馏I2的苯溶液可获取I2并回收苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I和Ⅱ的物质的量浓度均为0.001mol•L-1 | |
| B. | 将I稀释10倍,溶液中 c(CH3COOH)、c(OHˉ)均减小 | |
| C. | I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量 | |
| D. | I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH--) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 实验室制备硝基苯,将苯和浓硝酸混合后加热即可 | |
| C. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| D. | 1mol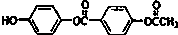 与足量的NaOH溶液加热充分反应,能消耗5molNaOH 与足量的NaOH溶液加热充分反应,能消耗5molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
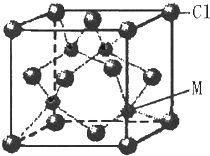 已知W、X、Y、Z、R五种元素是短周期的元素,原子序数依次增大,其中X 的基态原子中成对的电子的对数与单个电子的数目相同,Y 是地壳中含量最多的元素,R的单质是淡黄色固体,不溶于水,能溶于CS2.在短周期中:W的原子半径最小,Z 的原子半径最大.又知M是第四周期的元素,M的最外层只有一个单电子,次外层的轨道上全部填充满了电子.
已知W、X、Y、Z、R五种元素是短周期的元素,原子序数依次增大,其中X 的基态原子中成对的电子的对数与单个电子的数目相同,Y 是地壳中含量最多的元素,R的单质是淡黄色固体,不溶于水,能溶于CS2.在短周期中:W的原子半径最小,Z 的原子半径最大.又知M是第四周期的元素,M的最外层只有一个单电子,次外层的轨道上全部填充满了电子.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H2 C2H4 CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H和${\;}_{1}^{3}$H互为同位素 | |
| B. | O2和O3互为同一种物质 | |
| C. | 金刚石、C60和石墨互为同素异形体 | |
| D. | CH3(CH2)2CH3和CH(CH3)3互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com