
| 2mol |
| 1mol+0.5mol+2mol |
| 4×10-5×0.1 |
| 1 |
| 3 |
| 0.7mol |
| 1L |
| 4 |
| p |
| 2 |
| p |
| 4 |
| p |
| 2 |
| p |
| 2mol |
| 1mol+0.5mol+2mol |
| (2-a)mol |
| (3.5+0.5a)mol |


科目:高中化学 来源: 题型:
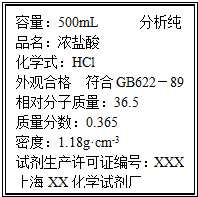 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L的NaOH溶液中钠离子数为0.1NA |
| B、1.8g重水(D2O)中,含有的质子数为0.1NA |
| C、5.6g铁投入浓硫酸中,生成的气体分子数为0.1NA |
| D、标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.20 | 0.10 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Ba2+、NH4+ |
| 阴离子 | SO42-、Cl-、OH-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 不同压强下的转化率/% | |||
| 0.1MPa | 0.5MPa | 1MPa | 10MPa | |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3] |
| B、0.1mol?L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-] |
| C、CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c (Na2CO3)<c(CH3COONa) |
| D、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量OH-的溶液:Na+、K+、NO3-、CO32- |
| B、含有大量H+的溶液:HCO3-、K+、SO42-、Cl- |
| C、含大量Fe3+的溶液:NH4+、Na+、SCN-、OH- |
| D、含有大量CO32-的溶液:Ca2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com