
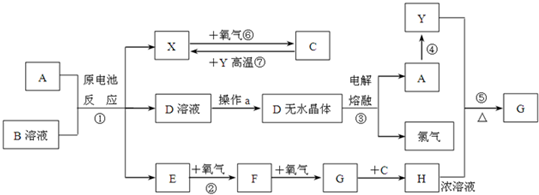
分析 C为无色液体,由气体X(X由原电池反应得到,可能是H2)和氧气反应得到,故C应是H2O,X是H2,根据反应⑦可知非金属Y是C.由电解D无水晶体得到A与Cl2,可知D为氯化物且是离子化合物,结合A+B溶液发生原电池反应得到X、D、E,可知B为氯化物,且B是一种盐,受热极易分解,反应生成的H2与E气体,B应水解呈酸性,由转化关系:E→F→G→H,属于常温下气体E的连续氧化得到气体G,在中学阶段中N、S元素化合物符合转化关系,考虑反应①是金属与NH4Cl溶液发生的原电池反应,可推出E为NH3、F为NO、G为NO2,则H为HNO3.(1)中反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,应为Mg与二氧化碳的反应,可推出A为Mg,则D为MgCl2,结合反应①可推知B为NH4Cl,验证符合转化关系,据此解答.
解答 解:C为无色液体,由气体X(X由原电池反应得到,可能是H2)和氧气反应得到,故C应是H2O,X是H2,根据反应⑦可知非金属Y是C.由电解D无水晶体得到A与Cl2,可知D为氯化物且是离子化合物,结合A+B溶液发生原电池反应得到X、D、E,可知B为氯化物,且B是一种盐,受热极易分解,反应生成的H2与E气体,B应水解呈酸性,由转化关系:E→F→G→H,属于常温下气体E的连续氧化得到气体G,在中学阶段中N、S元素化合物符合转化关系,考虑反应①是金属与NH4Cl溶液发生的原电池反应,可推出E为NH3、F为NO、G为NO2,则H为HNO3.(1)中反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,应为Mg与二氧化碳的反应,可推出A为Mg,则D为MgCl2,结合反应①可推知B为NH4Cl,验证符合转化关系,
(1)反应④为Mg与二氧化碳的反应生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)Mg与石墨作电极,NH4Cl的浓溶液作电解质,构成原电池,Mg为负极,石墨为正极,负极反应:Mg-2e-=Mg2+,正极反应:2NH4++2e-=NH3↑+H2↑,
故答案为:Mg-2e-=Mg2+;2NH4++2e-=NH3↑+H2↑;
(3)从MgCl2溶液制备MgCl2的无水晶体,应注意防止水解,应将D溶液在HCl气流中蒸干,
故答案为:将D溶液在HCl气流中蒸干;
(4)反应②是氨的催化氧化,反应化学方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)反应⑤是碳与浓硝酸反应生成CO2、NO2、H2O,方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查无机物的推断、原电池、金属镁的性质、氮及其化合物的性质,侧重于学生的分析能力和元素化合物知识的综合运用的考查,为高考常见题型,注意把握题给信息,结合转化关系进行推断,(2)为易错点,该原电池实质为铵根离子水解,Mg再与氢离子反应生成氢气,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
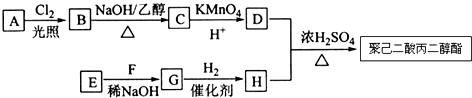
 .
. .
.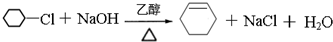 .
.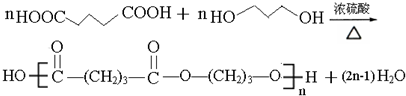 .
.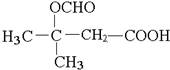 (写出其中一种结构简式).
(写出其中一种结构简式).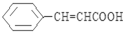 )的合成路线示意图.
)的合成路线示意图.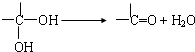
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸都能与钠反应 | |
| B. | 乙醇、乙酸互为同分异构体 | |
| C. | 乙醇、乙酸都是高分子化合物 | |
| D. | 乙醇、乙酸都能使紫色石蕊试液变红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com