
分析 氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,
(1)反应中铜元素0价变化为+2价,3mol铜反应失去电子为6mol,氮元素化合价+5价变化为+2价,2mol硝酸根离子失电子生成NO,得到6mol电子;
(2)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:(1)反应中铜元素0价变化为+2价,3mol铜反应失去电子为6mol,氮元素化合价+5价变化为+2价,2mol硝酸根离子失电子生成NO,得到6mol电子则电子转移的方向和数目为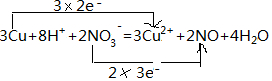 ,
,
答:反应的双线桥表示的氧化还原反应为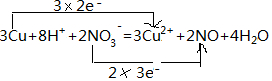 ;
;
(2)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由-1价升高到0价,被氧化,既是氧化产物也是还原产物,得电子与失电子个数相等,比值为1:1,氧化产物和还原产物的质量之比是5:1,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
答:反应的双线桥表示的氧化还原反应为 .
.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及发生的反应为解答的关键,侧重双线桥表示电子转移方向和数目的考查,注重基础知识的夯实,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 可利用该反应进行人工固氮 | |
| B. | 将3mol N2(g)和3mol H2(g)混合,在高温、高压和催化条件下充分反应,放出热量92.22kJ | |
| C. | 因为反应需要加热,所以反应放出热量 | |
| D. | 其他条件相同时,采用更高效的正催化剂,既能提高反应速率,又能增大反应放热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶解性 | 沸点 | 密度(g/mL) | |
| 乙醇 | 与水互溶 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水 | 38.4 | 1.4 |
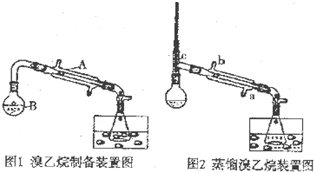
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2022 kJ | B. | 2670 kJ | C. | 1698kJ | D. | 2346 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
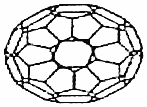
| A. | C60的摩尔质量是720 g•moL-1 | |
| B. | 1 mol C60完全燃烧生成22.4 L CO2 | |
| C. | C60属于有机化合物 | |
| D. | C60的结构与金刚石一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近 pH 值减小 | |
| B. | 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O | |
| C. | 放电时,负极上发生反应的物质是Fe(OH)2 | |
| D. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是负极 | B. | Y是正极 | C. | Y极发生还原反应 | D. | Y极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- | |
| D. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com