
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 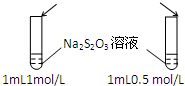 | 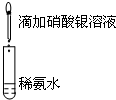 |
| C.目的:比较Al、Fe、Cu活动性 | D.目的:实验室制取氨气 |
 |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.只有亚硫酸钠的浓度一个变量;
B.向硝酸银中滴加氨水,至最初生成的沉淀恰好溶解制备银氨溶液;
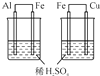
C.构成原电池的金属电极,较活泼金属作负极;
D.氯化铵和氢氧化钙在加热条件下反应生成氯化钙和氨气,氨气密度小于空气,应该采用向下排空气法收集.
解答 解:A.只有亚硫酸钠的浓度一个变量,则图中装置可探究浓度对反应速率影响,故A正确;
B.向硝酸银中滴加氨水,至最初生成的沉淀恰好溶解制备银氨溶液,则图中装置不可制备银氨溶液,故B错误;
C.构成原电池的金属电极,较活泼金属作负极,Al、Fe和稀硫酸构成的原电池中,Al作负极、Fe作正极,活泼性Al>Fe,Fe、Cu和稀硫酸原电池中,Fe作负极、Cu作正极,则活泼性Fe>Cu,所以金属活泼性Al>Fe>Cu,故C正确;
D.氯化铵和氢氧化钙在加热条件下反应生成氯化钙和氨气,氨气密度小于空气,应该采用向下排空气法收集,该装置能制取并收集氨气,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及反应速率影响因素探究、溶液配制、金属活动性强弱判断、气体制取和收集等知识点,明确实验原理、物质性质及实验基本操作是解本题关键,注意B中配制溶液注意事项,为易错点.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol浓盐酸与足量MnO2 反应,可以得到0.5mol氯气 | |
| B. | 区别氯化钠溶液和氯化钾溶液,目前我们做不到 | |
| C. | 影响气体体积的主要因素是:分子大小、分子间距、分子数目 | |
| D. | 漂白粉露置空气中变质,既发生氧化反应又发生非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
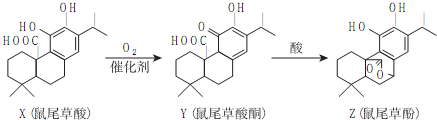
| A. | X、Z属于芳香族化合物 | |
| B. | X、Y、Z均能与FeCl3溶液发生显色反应 | |
| C. | 1molX或1molZ与NaOH溶液反应,均最多消耗3molNaOH | |
| D. | Z能与溴的四氯化碳溶液发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA | |
| B. | 1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| C. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.9NA个电子 | |
| D. | 等体积、浓度均为1mol•L-1的磷酸和盐酸,电离出的氢离子数之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com