
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸
化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是( )
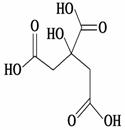 A.X的分子式为C6H7O7
A.X的分子式为C6H7O7
B.1 mol物质X最多可以和3 mol氢气发生加成反应
C.X分子内所有原子均在同一平面内
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应
得到的气体的物质的量相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1。分别向1 L 0.5 mol·L-1的NaOH溶液中加入:①稀醋酸、②浓H2SO4、③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH1<ΔH3
C.ΔH1=ΔH2=ΔH3 D.ΔH1>ΔH3>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______________________。
(2)④、⑤、⑦、⑧四种溶液中NH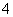 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH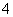 )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH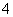 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
以下四种有机物的分子式皆为C4H10O:
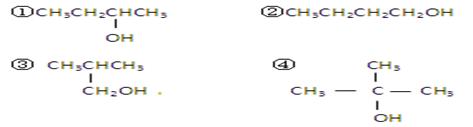
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
A.①② B.只有② C.②和③ D.③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合 只要物质的量之和不变,完全燃烧时所消耗的氧气量和生成水的物质的量也分别不变则下列有关判断正确的是: ( )
A、X、Y分子式中氢原子数不一定要相同,碳原子数必定不同
B、若X为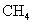 ,则相对分子质量最小的Y是甲醇
,则相对分子质量最小的Y是甲醇
C、若X为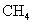 ,则相对分子质量最小的Y是乙二醇
,则相对分子质量最小的Y是乙二醇
D、X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案设计中,可行的是
A.在水中加入氯化铁晶体,加热至沸腾,可得到氢氧化铁胶体
B.氢氧化铁胶体中的H+、Cl-可用过滤的方法除去
C.用蒸发的方法使NaCl从溶液中析出时,将蒸发皿中NaCl溶液全部加热蒸干
D.鉴别氯化铁溶液与氢氧化铁胶体较简便的方法是用激光束照射
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学学习小组为了解硫酸及其盐的某些性质和用途,进行了如下实验探究。
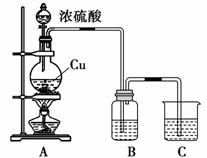
[实验一] 探究浓硫酸的氧化性:
(1)写出烧瓶中反应的化学方程式:____________________________________。
(2)B装置可用于探究SO2的还原性,则B中所用的试剂为:________________(任写一种即可);若B装置是品红溶液,则B中的现象是_______________________________。
[实验二] 检验(NH4)2Fe(SO4)2·6H2O中的金属离子:
(3)请结合化学用语和必要的文字说明如何检验出其中的金属离子(试剂、原理、现象等):______________________________________________________________________。
[实验三] 用KHSO4制取H2O2并测其质量分数:
查阅资料得知:工业上用如下原理制取H2O2:
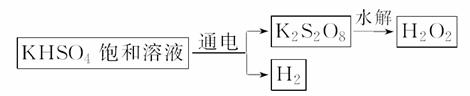
现用此法制取一定浓度的H2O2,并测定H2O2的质量分数。
已知:2MnO +5H2O2+6H+===2Mn2++8H2O+5O2↑
+5H2O2+6H+===2Mn2++8H2O+5O2↑
①取10.00 mL H2O2溶液(密度为1.00 g·mL-1)置于锥形瓶中加水稀释,并加稀硫酸酸化;
②用0.200 0 mol·L-1KMnO4溶液滴定;
③用同样方法滴定四次,消耗KMnO4溶液的体积分别为:40.00 mL、39.98 mL、42.02 mL、40.02 mL。
(4)用该原理制取H2O2的阳极电极反应式为_______________________________。
(5)进行操作②时,滴入第一滴KMnO4溶液,溶液的紫红色消失很慢,随着滴定的进行,溶液的紫红色消失速率加快,推测其原因可能是_____________________________。
(6)此H2O2溶液中溶质的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物中,含有非极性共价键的离子化合物是( )
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3
Ⅱ. [2013·海南卷] (14分)
图(a)所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图(b)所示。
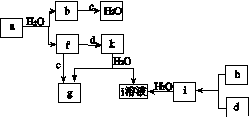
(a)

(b)
回答下列问题:
(1)图(b)对应的物质名称是________,其晶胞中的原子数为________,晶体的类型为________。
(2)d中元素的原子核外电子排布式为____________。
(3)图(a)中由二种元素组成的物质中,沸点最高的是________,原因是____________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图(a)中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com