
科目:高中化学 来源: 题型:阅读理解



| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
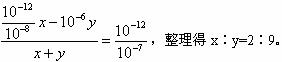
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度上升至100 ℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,若使混合液的pH=7,则Ba(OH)2与盐酸的体积比为________。
(3)已知AnBm的离子积为{c(Am+)}n·{c(Bn-)}m,式中的c(Am+)和c(Bn-)表示离子的物质的量浓度。若某温度下,Ca(OH)2溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为____________________。另取少许上层清液,先滴加适量的_________ (填化学式)酸化,再滴加_________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈__________性并具有__________性。
(2)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl====2Cl2↑+CaCl2+2H2O
该反应中,每生成1 mol Cl2,转移电子物质的量为__________,被氧化的HCl的物质的量为__________。
有效氯是漂粉精中有效成分Ca(ClO)2的含量大小标志,已知:有效氯
=![]() ×100%
×100%
若某漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数=___________。
(计算结果保留小数点后1位。已知相对分子质量用Mr表示:Mr(Cl2)=71,Mr[Ca(ClO)2]=143)
(3)现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂粉精,甲、乙、丙三人分别设计三个实验装置,如图1-3-1所示。已知Cl2与Ca(OH)2制漂粉精的反应是放热反应,而在较高温度下即发生如下反应:
6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O

图1-3-1
①请指出三个装置各自的缺点或错误(如没有可不填):
甲____________________________________________________________,
乙____________________________________________________________,
丙____________________________________________________________。
②图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置__________ (填所选部分的编号)。
③实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________ (假定各步反应均无反应损耗且无副反应发生)。
查看答案和解析>>
科目:高中化学 来源: 题型:

图10-6
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到? ?。?
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。?
(3)已知A![]() B
B![]() 的离子积=c(A
的离子积=c(A![]() )
)![]() c(B
c(B![]() )
)![]() ,式中c(A
,式中c(A![]() )和c(B
)和c(B![]() )表示离子的物质的量浓度,在某温度下,Ca(OH)2的溶解度为
)表示离子的物质的量浓度,在某温度下,Ca(OH)2的溶解度为
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 1.2硬水软化练习卷(解析版) 题型:填空题
某自来水中含有Ca2+、Mg2+、Na+、K+、 、
、 、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
|
物质 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
CaSO4 |
MgSO4 |
|
溶解度 g/100 g H2O |
9.0×10-4 |
1.5×10-3 |
1.0×10-2 |
1.7×10-1 |
2.1×10-1 |
26.7 |
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:
________________________________________________________________________
________________________________________________________________________。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是____________。(填序号)
A.NaOH B.NaHCO3
C.Na2CO3 D.NaCl
CaSO4能转化为物质Y的原因是(用文字叙述)_______________________________________
________________________________________________________________________。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)_________________ _______________________________________________________。
(4)若所用自来水的硬度为33.6度(计算硬度是将Ca2+、Mg2+都看成Ca2+,并将其折算成相当于CaO的质量,通常1 L水中含有10 mg CaO称为1度)。1 t这样的水中相当于含CaO的物质的量为__________(水的密度为1 g/cm3)。
(5)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40 g/L的自来水样10 mL至锥形瓶中进行滴定,达到滴定终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com