
 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
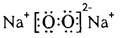


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
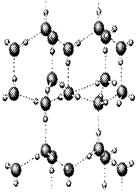
 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8
)中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8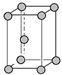 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12
中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.MgB | B.Mg3B6 | C.Mg5B12 | D.Mg14B6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li Na K Rb | B. NaF NaCl NaBr NaI |
| C.F2 Cl2 Br2 I2 | D.H2O H2S H2Se H2Te |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.O2、I2、Hg | B.CO2、KCl、SiO2 | C.Na、K、Rb | D.NaCl、KCl、RbCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
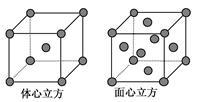
| A.在SiO2晶体中,每个Si原子与4个O原子形成共价键 |
| B.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子 |
| C.NaCl晶体中与每个Na+距离相等且最近的Cl—有6个; |
| D.CsCl晶体中与每个Cs+距离相等且最近的Cl—有8个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com