
�����Ȼ�ѧ����ʽ��S(l)��O2(g)===SO2(g) ��H����293��23 kJ��mol��1 ����������˵������ȷ����
A��S(s)��O2(g)===SO2(g)����Ӧ�ų�����������293��23 kJ��mol��1 ��
B��S(g)��O2(g)===SO2(g)����Ӧ�ų�������С��293��23 kJ��mol��1 ��
C��1 mol SO2(g)�ļ��ܵ��ܺʹ���1 mol S(l)��1 mol O2(g)�ļ���֮�͡�
D��1 mol SO2(g)�ļ��ܵ��ܺ�С��1 mol S(l)��1 mol O2(g)�ļ���֮�͡�
 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ��ݸ����У��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���л�ѧ��Ӧ�����ӷ���ʽ��
A��ϡ���������۷�Ӧ��Fe+2H+=Fe2++H2��
B��̼�ᱵ���ڴ��BaCO3+2H+ =Ba2++H2O+CO2��
C��пƬ������������Һ�У�Zn+2Ag+=Zn2++2Ag
D������ͭ��Һ������������Һ��Ӧ��Ba2++SO42-=BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡУ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и����������������Һ�еķ�Ӧ������ͬһ���ӷ���ʽ��ʾ����
A����������������������������
B��BaCl2��Һ��Na2SO4��Һ��Ba(OH)2��Һ��H2SO4��Һ
C��Na2CO3��Һ��������Һ��CaCO3��Һ��������Һ
D��ʯ��ʯ�����ʯ��ʯ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���г���ʱpH��1��ijǿ����Һ10 mL�����в�����ʹ��Һ��pH���2����
A����ˮϡ�ͳ�100 mL��
B������10 mL��ˮ����ϡ�͡�
C������10 mL 0��01 mol/L��NaOH��Һ��
D������10 mL 0��01 mol/L��HCl��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£���ij�ܱ������н������·�Ӧ��mA(g)��nB(g) pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬��Ӧ������ʱ��ı仯������ͼ��ʾ��
pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬��Ӧ������ʱ��ı仯������ͼ��ʾ��
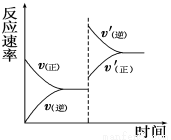
��Ը÷�Ӧ��������ȷ����
A������Ӧ�����ȷ�Ӧ B���淴Ӧ�Ƿ��ȷ�Ӧ
C��m��n<p��q D��m��n>p��q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�������
��8�֣���֪�ƾ�ȼ�յ��Ȼ�ѧ����ʽ�ǣ�
C2H5OH(l) + 3O2(g)��2CO2(g) + 3H2O(l)����H= -1370.3kJ/mol��
��ȼ��0.10g�ƾ������ɶ�����̼��Һ̬ˮ���ų���������ʹ100gˮ���¶����߶��١棿
[c(ˮ) = 4.184 J/��g���棩��M( C2H5OH)= 46 g/mol ��������������λС��]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��6�֣�����ƽ�����ʢ��ǿ��ԭ��Һ̬�£�N2H4����ǿ������Һ̬˫��ˮ�������ǻ�Ϸ�Ӧʱ������������������ˮ���������ų��������ȡ���֪0.4molҺ̬����������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.652KJ��������
��1����Ӧ���Ȼ�ѧ����ʽΪ ��
��2������֪H2O(l)��H2O(g)����H=+44kJ/mol����16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų��������� KJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͬ��ͬѹ�£���֪���и���ӦΪ���ȷ�Ӧ�����и��Ȼ�ѧ����ʽ��������ֵ��С����
A��2A ( l ) + B ( l ) = 2C (g ) ��H1
B��2A ( g ) + B ( g ) = 2C (g ) ��H2
C��2A ( g ) + B ( g ) = 2C ( l ) ��H3
D��2A ( l ) + B ( l ) = 2C ( l ) ��H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A����Ӧ�Ⱦ��Ƿ�Ӧ�зų�������
B����101KPaʱ��1mol̼ȼ�����ų�������Ϊ̼��ȼ����
C����C��ʯī��s��=C�����ʯ��s����H����1.9kJ/mol����֪���ʯ��ʯī�ȶ�
D���������������������ֱ���ȫȼ�գ�ǰ�߷ų���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com