
| A. | Na+、Al3+、Cl-、OH-(5:2:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、NO3-(1:1:1:1) |
分析 A.铝离子与氢氧根离子按照2:4反应会生成氢氧化铝沉淀;
B.铵根离子与氢氧根离子、钡离子与氯离子组合可以得到无色、碱性、澄清溶液;
C.铁离子与硫离子发生氧化还原反应生成亚铁离子和硫单质;
D.硝酸根离子在酸性条件下将碘离子氧化成碘单质,得到橙色溶液.
解答 解:A.Al3+、OH-以2:4反应生成氢氧化铝沉淀,故A错误;
B.NH4+、OH-以1:1反应生成一水合氨,得到无色、碱性、澄清溶液,满足题干要求,故B正确;
C.Fe3+、S2-发生氧化还原反应生成亚铁离子和S,得到浅绿色溶液,故C错误;
D.H+、I-、NO3-发生氧化还原反应,生成碘水,呈橙色,故D错误;
故选B.
点评 本题考查了常见离子的性质及应用,题目难度中等,明确常见离子的性质为解答关键,D为易错点,注意硝酸根离子在酸性条件下具有强氧化性,试题培养了学生的灵活应用能力.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:推断题
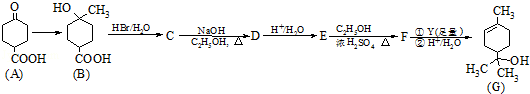
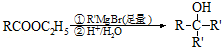
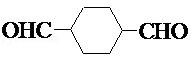 .
. .
.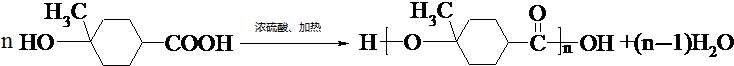 .
.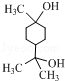 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
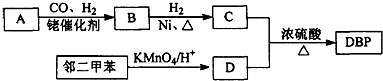

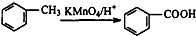
 .
. .
.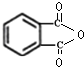 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
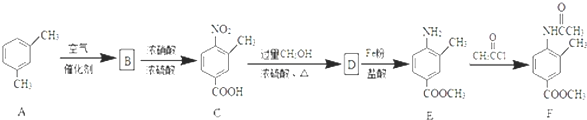
 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
.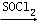 RCOCl.请写出以CH3CH2OH、
RCOCl.请写出以CH3CH2OH、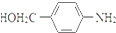 为原料,制备化合物
为原料,制备化合物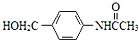 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2 CH3CH2Br
CH3CH2Br CH3CH2OH.
CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
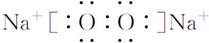 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
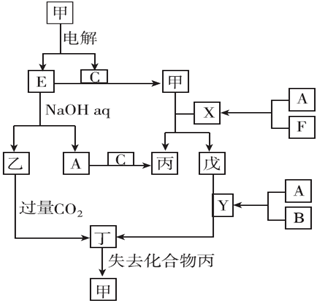
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 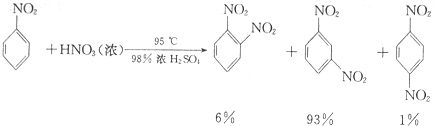
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com