
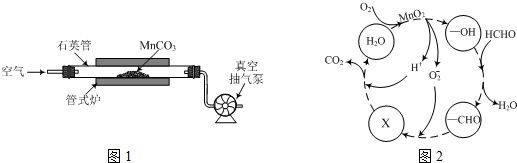
分析 (1)根据盖斯定律计算;
(2)①化学平衡常数表达式等于生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动;
(3)根据图示X加H+生成CO2和H2O解答;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,配平书写电极反应式.
解答 解:(1)根据盖斯定律,①3MnO2(s)=Mn3O4(s)+O2(g)△H1=a kJ•mol-1②3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s)△H2=b kJ•mol-1③Al(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=c kJ•mol-1,则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s)△H=①+$\frac{1}{3}$×②+$\frac{4}{3}$×③=(a+$\frac{1}{3}$b+$\frac{4}{3}$c) kJ•mol-1,
故答案为:a+$\frac{1}{3}$b+$\frac{4}{3}$c;
(2)①化学平衡常数表达式等于生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式,则K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$,故答案为:$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$;
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动,可提高MnCO3的转化率,故答案为:使平衡正向移动,提高MnCO3的转化率;
(3)根据图示X加H+生成CO2和H2O,则X表示的粒子是HCO3-,根据图示可得该反应的总反应方程式为:HCHO+O2=CO2+H2O,故答案为:HCO3-;HCHO+O2=CO2+H2O;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,阴极水得电子发生还原反应生成氢气,氢氧根浓度增大,则电解过程中阴极附近的pH增大,
故答案为:Mn2++2H2$\frac{\underline{\;电解\;}}{\;}$MnO2+H2↑+2H+;增大.
点评 本题主要考查盖斯定律计算反应热,及平衡常数表达式、电解基本原理,题目难度不大,注意固体不代入平衡常数表达式.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:选择题
| A.秦朝铜车马 | B.春秋越王剑 | C.唐三彩 | D.商代司母戊鼎 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫、二氧化氮、一氧化碳和二氧化碳是空气质量报告中涉及的主要污染物 | |
| B. | 正常雨水的pH等于7 | |
| C. | 二氧化硫和二氧化氮是引起酸雨的主要气体 | |
| D. | 家用汽车有利于人们出行,需要大力推广应用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | W的气态简单氢化物的热稳定性比X的强 | |
| D. | 工业上可用X的单质与W的氧化物反应制备W的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖和蔗糖的水解产物相同 | |
| B. | 用新制的氢氧化铜可区分乙醇、乙醛 | |
| C. | 用高锰酸钾酸性溶液可以区分苯、甲苯 | |
| D. | 用饱和溴水可区分苯酚溶液、己烷、1-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的氢化物是同主族简单氢化物中最稳定的 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y的最高价氧化物对应的水化物酸性后者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 Mg-H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )
Mg-H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 该电池的总反应为:Mg+H2O2═Mg(OH)2 | D. | 溶液中Cl-向正极移动 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:填空题
A过滤法;B结晶法;C分液法;D萃取分液法;E蒸馏法;F升华法
(l)除去食盐水中的泥沙_________________(2)除去植物油中的水_________________
(3)将溶液中的硝酸钾与氯化钠分离____________(4)将自来水制为纯净水________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com