
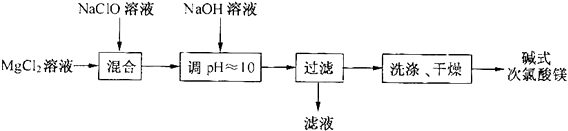
���� ��MgCl2��Һ�м���NaClO��Һ��Ȼ������Һ�м���NaOH��Һ��������Һ��pH����ʽ������þ[Mg2ClO��OH��3•H2O]����ˮ�����Եõ���ʽ������þ[Mg2ClO��OH��3•H2O]������NaCl�����˵õ���ʽ������þ[Mg2ClO��OH��3•H2O]���壬��Һ�гɷ���NaCl��Ȼ����ϴ�ӡ�����õ���ʽ������þ[Mg2ClO��OH��3•H2O]��
��1����Һ�е���Ҫ������NaCl��
��2��Cl2��NaOH��Һ��Ӧ����NaCl��NaClO��H2O��
��3��Mg2ClO��OH��3•H2O��ʽ��Ϊ168.5��Mg2ClO��OH��3•H2O��Mg��������ֵ=$\frac{24��2}{168.5}$=28.49%������ʵ��Mg����������ֵ�Ƚ�ȷ��ƫ����ƫ�ͣ�
��Mg2ClO��OH��3•H2O��ClO-��Cl2��Mg2ClO��OH��3•H2O����Ч�ȵ�����ֵ=$\frac{35.5��2}{168.5}$=42.14%����������ֵ��ʵ��ֵ������Ч��ƫ����ƫ�ͣ�
��� �⣺��MgCl2��Һ�м���NaClO��Һ��Ȼ������Һ�м���NaOH��Һ��������Һ��pH����ʽ������þ[Mg2ClO��OH��3•H2O]����ˮ�����Եõ���ʽ������þ[Mg2ClO��OH��3•H2O]������NaCl�����˵õ���ʽ������þ[Mg2ClO��OH��3•H2O]���壬��Һ�гɷ���NaCl��Ȼ����ϴ�ӡ�����õ���ʽ������þ[Mg2ClO��OH��3•H2O]��
��1����Һ�е���Ҫ������NaCl��������Һ�пɻ��յ���Ҫ������NaCl���ʴ�Ϊ��NaCl��
��2��Cl2��NaOH��Һ��Ӧ����NaCl��NaClO��H2O����Ӧ����ʽΪ2NaOH+Cl2=NaCl+NaClO+H2O���ʴ�Ϊ��2NaOH+Cl2=NaCl+NaClO+H2O��
��3��Mg2ClO��OH��3•H2O��ʽ��Ϊ168.5��Mg2ClO��OH��3•H2O��Mg��������ֵ=$\frac{24��2}{168.5}$=28.49%��ij��ʽ������þ��Ʒ��þ����Ϊ29.01%��28.49%������þ����ƫ�ߣ�
��Mg2ClO��OH��3•H2O��ClO-��Cl2��Mg2ClO��OH��3•H2O����Ч�ȵ�����ֵ=$\frac{35.5��2}{168.5}$=42.14%��40.28%������ƫ�ͣ�
�ʴ�Ϊ��ƫ�ߣ�ƫ�ͣ�
���� ���⿼�������Ʊ���Ϊ��Ƶ���㣬���ؿ���ѧ���Ի�ѧ�������̵������������ȷ����ͼ�з����ķ�Ӧ�����������ǽⱾ��ؼ����ѵ��ǣ�3������㣬��Ŀ�Ѷ��еȣ�


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | ������ | �ж� | |
| A | ���ǵؿ��к�����ߵĽ���Ԫ�� | ������������ʹ�õĽ������� | ��ԣ���ԣ��� |
| B | ����������ϡ���ᷴӦ�������� | �����������ܻ�ԭ�������õ��� | ��ԣ���ԣ��� |
| C | �����ڹ���Ԫ�� | ��������ijЩ��������������� | �������ԣ��� |
| D | �ڿ������������γ���������Ĥ | ��������������Ӧ | ��ԣ���ԣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CuCl2 NH4Cl Fe2��SO4��3 NaNO3 | |
| B�� | ��NH4��2SO4 CuSO4 Na2CO3 FeCl3 | |
| C�� | Cu��NO3��2 NH4 NO3 FeCl3 H2S | |
| D�� | Ba Cl2 Cu��NO3��2 ��NH4��2SO4 Fe ��NO3��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
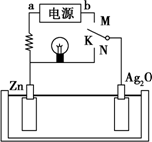 ��ͼ��ij���ε�س䡢�ŵ�ʱ�Ĺ���ʾ��ͼ����֪�ŵ�ʱ��ط�ӦΪZn+Ag2O+H2O�T2Ag+Zn��OH��2�������й�˵����ȷ���ǣ�������
��ͼ��ij���ε�س䡢�ŵ�ʱ�Ĺ���ʾ��ͼ����֪�ŵ�ʱ��ط�ӦΪZn+Ag2O+H2O�T2Ag+Zn��OH��2�������й�˵����ȷ���ǣ�������| A�� | �ŵ�ʱ�ĸ�����Ӧ�ͳ��ʱ��������Ӧ���ڿ��淴Ӧ | |
| B�� | �ڵ�طŵ��������Һ��pH���� | |
| C�� | K��N���ʱ�������ɻ�ѧ��ת��Ϊ���ܣ���Һ�е�OH-���������ƶ� | |
| D�� | K��M����ʱ�����õ�Դ��a��Ϊ����������������Һ��pH������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʯī���缫����Ȼ�����Һ��2Cl-+2H2O�T2OH-+H2��+Cl2�� | |
| B�� | FeBr2��Һ��ͨ������������2Fe2++2Br-+2Cl2�T2Fe3++Br2+4Cl- | |
| C�� | Fe3O4��HCl��Fe3O4+8H+�T2Fe3++Fe2++4H2O | |
| D�� | Fe2O3��Hl��Fe2O3+6H+�T2Fe3++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com