
”¾ĢāÄæ”æ“óĘųÖŠSO2ŗĶNoxŹĒŠĪ³ÉĖįÓźµÄÖ÷ŅŖĪļÖŹ£¬Ī£ŗ¦»·¾³£®
£Ø1£©Ä³ŃŠ¾æŠ”×éĪŖĮĖĢ½¾æ²ĪÓėµÄĮņĖįŠĶĖįÓźµÄŠĪ³É£¬ŌŚÉÕĘæÖŠ³äČėŗ¬ÓŠÉŁĮæNOµÄSO2ĘųĢ壬ĀżĀżĶØČėO2 £¬ øĆ¹ż³ĢÖŠ·¢ÉśµÄ»Æѧ·“Ó¦ÓŠ”¢£» ŌŁÅēÉ䏏ĮæÕōĮóĖ®¼“æɵĆĮņĖįŠĶĖįÓź£¬ĘäÖŠNOµÄ×÷ÓĆŹĒ £®
£Ø2£©¼õÉŁSO2µÄĪŪČ¾²¢±ä·ĻĪŖ±¦ŹĒŅ»ĻīŗÜÖŲŅŖµÄŃŠ¾æ¹¤×÷£®ĪŅ¹śÕżŌŚĢ½Ė÷ŌŚŅ»¶ØĢõ¼žĻĀÓĆCO»¹ŌSO2µĆµ½µ„ÖŹĮņµĆ·½·ØĄ“³żČ„SO2 £¬ øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø3£©ÓŠČĖĢį³ö£ŗÓĆ°±Ė®½«SO2×Ŗ»ÆĪŖNH4HSO3 £¬ ŌŁŃõ»Æ³É£ØNH4£©2SO4Ą“ĶŃ³żŃĢĘųÖŠµÄSO2 £¬ ŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©
£Ø4£©ĪŖ·ĄÖ¹ĪŪČ¾£¬½«NO”¢NO2ĶźČ«×Ŗ»ÆĪŖ×īøß¼Ūŗ¬ŃõĖįŃĪ£¬ĻūŗÄ1L2.4mol/LnaOHČÜŅŗŗĶ1molO2 £¬ ŌņĮ½ÖÖĘųĢåµÄĪļÖŹµÄĮæ·Ö±šĪŖ”¢ £®
”¾“š°ø”æ
£Ø1£©2NO+O2=2NO2£»NO2+SO2=SO3+NO£»“߻ƼĮ
£Ø2£©SO2+2CO ![]() S+2CO2
S+2CO2
£Ø3£©4NH3+2SO2+2H2O+O2=4NH4++2SO42©
£Ø4£©0.8 molNO£»1.6 molNO2
”¾½āĪö”æ½ā£ŗ£Ø1£©Ņ»Ńõ»ÆµŖ¾ßÓŠ»¹ŌŠŌ£¬ŗÜČŻŅ×±»ŃõĘųŃõ»Æ£¬·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗ2NO+O2=2NO2 £¬ ¶žŃõ»ÆµŖÄܽ«¶žŃõ»ÆĮņŃõ»Æ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗNO2+SO2=SO3+NO£¬×Ü·“Ó¦ĪŖ£ŗ2SO2+O2=2SO3 £¬ æɼūÕūøö¹ż³ĢŅ»Ńõ»ÆµŖµÄÖŹĮæƻӊ±ä»Æ£¬¹ŹNOŌŚ·“Ó¦ÖŠ×÷“߻ƼĮ£¬ ĖłŅŌ“š°øŹĒ£ŗ2NO+O2=2NO2£»NO2+SO2=SO3+NO£»“߻ƼĮ£»£Ø2£©CO»¹ŌSO2µĆµ½µ„ÖŹĮņŗĶ¶žŃõ»ÆĢ¼£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗSO2+2CO ![]() S+2CO2 £¬
S+2CO2 £¬
ĖłŅŌ“š°øŹĒ£ŗSO2+2CO ![]() S+2CO2£»£Ø3£©¹żĮ涞Ńõ»ÆĮņĶØČė°±Ė®ÖŠÉś³ÉŃĒĮņĖįĒāļ§£¬»Æѧ·½³ĢŹ½ĪŖ£ŗSO2+H2O+NH3=NH4HSO3 £¬ ·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗNH3+SO2+H2O=NH4++HSO3© £¬ +4¼ŪµÄĮņ±»ŃõĘųŃõ»Æ³É+6¼ŪµÄĮņ£¬Ąė×Ó·“Ó¦ĪŖ£ŗ4NH3+2SO2+2H2O+O2=4NH4++2SO42© £¬
S+2CO2£»£Ø3£©¹żĮ涞Ńõ»ÆĮņĶØČė°±Ė®ÖŠÉś³ÉŃĒĮņĖįĒāļ§£¬»Æѧ·½³ĢŹ½ĪŖ£ŗSO2+H2O+NH3=NH4HSO3 £¬ ·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗNH3+SO2+H2O=NH4++HSO3© £¬ +4¼ŪµÄĮņ±»ŃõĘųŃõ»Æ³É+6¼ŪµÄĮņ£¬Ąė×Ó·“Ó¦ĪŖ£ŗ4NH3+2SO2+2H2O+O2=4NH4++2SO42© £¬
ĖłŅŌ“š°øŹĒ£ŗ4NH3+2SO2+2H2O+O2=4NH4++2SO42©£»£Ø4£©½«NO”¢NO2ĶźČ«×Ŗ»ÆĪŖ×īøß¼Ūŗ¬ŃõĖįŃĪ£¬NO”¢NO2×īÖÕ×Ŗ»ÆĪŖNaNO3 £¬ 1molŃõĘų²ĪÓė·“Ó¦×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ4mol£¬Éč³öNO”¢NO2µÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬Ōņ£ŗx+y=2.4£ØÄĘŌ×ÓŹŲŗć£©£¬3x+y=4£Øµē×ÓŹŲŗć£©£¬½āµĆ£ŗx=0.8£¬y=1.6£¬
ĖłŅŌ“š°øŹĒ£ŗ0.8 molNO£»1.6 molNO2 £®
”¾æ¼µć¾«Īö”æ±¾ĢāÖ÷ŅŖæ¼²éĮĖ¶žŃõ»ÆĮņµÄĪŪČ¾¼°ÖĪĄķµÄĻą¹ŲÖŖŹ¶µć£¬ŠčŅŖÕĘĪÕSO2ŹĒĪŪČ¾“óĘųµÄÖ÷ŅŖÓŠŗ¦ĪļÖŹÖ®Ņ»£¬Ö±½ÓĪ£ŗ¦ŹĒŅżĘšŗōĪüµĄ¼²²”£»ŠĪ³ÉĖįÓźpH£¼5”¢6£¬ĘĘ»µÅ©×÷Īļ”¢ÉĮÖ”¢²ŻŌ”¢Ź¹ĶĮČĄĖįŠŌŌöĒæµČµČ£»ŗ¬SO2µÄ¹¤Ņµ·ĻĘų±ŲŠė¾¹ż¾»»Æ“¦Ąķ²ÅÄÜÅŷŵ½æÕĘųÖŠ²ÅÄÜÕżČ·½ā“š“ĖĢā£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚĆܱÕČŻĘ÷ÖŠµÄ·“Ó¦£ŗN2(g) +3H2(g)![]() 2NH3(g)”””÷H£¼0£¬673K”¢30MPaĻĀn(NH3)ŗĶn(H2)Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
2NH3(g)”””÷H£¼0£¬673K”¢30MPaĻĀn(NH3)ŗĶn(H2)Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ

A. µćaµÄÕż·“Ó¦ĖŁĀŹ±ČµćbµÄ“ó
B. µćc“¦·“Ó¦“ļµ½Ę½ŗā
C. µćd(t1Ź±æĢ) ŗĶµće(t2Ź±æĢ) “¦n(N2)Ņ»Ńł¶ą
D. ĘäĖūĢõ¼ž²»±ä£¬773 KĻĀ·“Ó¦ÖĮt2Ź±æĢ£¬n(NH3)±ČÉĻĶ¼ÖŠeµćµÄÖµ“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬²»ŹōÓŚ”°³ĒŹŠæÕĘųÖŹĮæČձؔ±±ØµĄµÄĪŪČ¾ĪļŹĒ£Ø £©
A£®¶žŃõ»ÆµŖ B£®¶žŃõ»ÆĢ¼ C£®æÉĪüČėæÅĮ£Īļ D£®¶žŃõ»ÆĮņ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±źæöĻĀ£¬µē½āŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄCuSO4ČÜŅŗŅ»¶ĪŹ±¼äŗ󣬼ÓČė0.2molCu(OH)2¹ĢĢåŹ¹ČÜŅŗĶźČ«»Öø“µ½³õŹ¼×“Ģ¬£¬Ōņ“Ė¹ż³ĢÖŠ¹²²śÉśĘųĢå
A. 6.72L B. 8.96L C. 11.2L D. 5.6L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāŃõ»ÆĀĮæÉ×÷ĪŖÖĪĮĘijÖÖĪø²”µÄÄŚ·žŅ©£¬ÕāŹĒĄūÓĆĮĖĒāŃõ»ÆĀĮµÄÄÄøöŠŌÖŹ ( )
A. ¼īŠŌ B. ĖįŠŌ C. Į½ŠŌ D. Ńõ»ÆŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻČēĶ¼Ģį¹©µÄŠÅĻ¢£¬ĻĀĮŠĖłµĆ½įĀŪÕżČ·µÄŹĒ£Ø £© 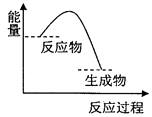
A.øĆ·“Ó¦¹ż³ĢÖŠ£¬ŠĪ³ÉŠĀ»Æѧ¼üŹĶ·ÅµÄ×ÜÄÜĮæŠ”ÓŚ¶ĻĮŃ¾É»Æѧ¼üĪüŹÕµÄ×ÜÄÜĮæ
B.ŅņĪŖÉś³ÉĪļµÄ×ÜÄÜĮæµĶÓŚ·“Ó¦ĪļµÄ×ÜÄÜĮ棬ĖłŅŌøĆ·“Ó¦²»ŠčŅŖ¼ÓČČ¼“æɽųŠŠ
C.øĆĶ¼ĻóæÉŅŌ±ķŹ¾Ģ¼ĖįøĘŹÜČČ·Ö½āµÄÄÜĮæ±ä»Æ
D.øĆĶ¼ĻóæÉŅŌ±ķŹ¾ŠæÓėĻ”ĮņĖį·“Ó¦µÄÄÜĮæ±ä»Æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻŌŖĖŲÖÜĘŚ±ķµÄÖŖŹ¶ĶĘ²āŌ×ÓŠņŹżĪŖ115µÄŌŖĖŲ£¬ĻĀĮŠ¶ŌĖüµÄŠšŹöÕżČ·µÄŹĒ £Ø £©
¢ŁĪ»ÓŚµŚ7ÖÜĘŚ ¢Ś·Ē½šŹōŌŖĖŲ ¢Ū×īĶāµē×Ó²ćÓŠ5øöµē×Ó ¢Üƻӊ·ÅÉäŠŌ ¢ŻŹōÓŚµŖ×åŌŖĖŲ ¢ŽŹōÓŚļ¹ĻµŌŖĖŲ
A. ¢Ł¢Ū¢Ż B. ¢Ś¢Ü¢Ž C. ¢Ł¢Ū¢Ž D. ¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ25”ꏱ£¬Ļņ100 mLŗ¬ĀČ»ÆĒā14.6 gµÄŃĪĖįČÜŅŗĄļ·ÅČė5.60 g“æĢś·Ū£Ø²»æ¼ĀĒ·“Ó¦Ē°ŗóČÜŅŗĢå»żµÄ±ä»Æ£©£¬·“Ó¦æŖŹ¼ÖĮ2 minÄ©£¬ŹÕ¼Æµ½1.12 L£Ø±ź×¼×“æö£©ĒāĘų”£ŌŚ“ĖÖ®ŗó£¬ÓÖ¾¹ż4 min£¬Ģś·ŪĶźČ«Čܽā”£Ōņ£ŗ
£Ø1£©ŌŚĒ°2 minÄŚÓĆFeCl2±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ_____________________”£
£Ø2£©ŌŚŗó4 minÄŚÓĆHCl±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ______________________”£
£Ø3£©Ē°2 minÓėŗó4 minĻą±Č£¬·“Ó¦ĖŁĀŹ½ĻæģµÄŹĒ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗÓŠ»ś»ÆŗĻĪļA”«FµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼£¬DĪŖŹÆÓĶĮŃ½āµÄÖ÷ŅŖ²śĪļÖ®Ņ»£¬DŌŚ±ź×¼×“æöĻĀµÄĆܶČĪŖ1.25 g”¤L-1£¬CÄÜ·¢ÉśŅų¾µ·“Ó¦£¬FĪŖÓŠĻćĪ¶µÄÓĶדŅŗĢ唣

Ēė»Ų“š£ŗ
£Ø1£©ÓŠ»śĪļBÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅĆū³ĘŹĒ________________
£Ø2£©D”śBµÄ·“Ó¦ĄąŠĶŹĒ______________________
£Ø3£©B£«E”śFµÄ»Æѧ·½³ĢŹ½ŹĒ__________________________________________
£Ø4£©ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ______________”£
a£®ŌŚ¼ÓČČĢõ¼žĻĀ£¬ÓŠ»śĪļAŗĶC¶¼ÄÜŹ¹ŠĀÖĘµÄ¼īŠŌĒāŃõ»ÆĶŠü×ĒŅŗ²śÉś×©ŗģÉ«³Į¶Ø”£
b£®FŌŚ¼īŠŌĢõ¼žĻĀ¼ÓČČĖ®½āŹōÓŚČ”“ś·“Ó¦£¬ÓÖ½ŠŌķ»Æ·“Ó¦”£
c£®DŗĶŃõĘųŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦Ņ²æÉŅŌÖʵĆC»ņE”£
d£®ÓŠ»śĪļBÖŠŹĒ·ń»ģÓŠEæÉÓĆ½šŹōÄĘ½ųŠŠ¼ģ²ā”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com