
| 112×59.7% |
| 16 |
| 160×59.7% |
| 16 |
| 16×5 |
| 59.7% |
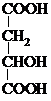 ,以此解答该题.
,以此解答该题.| 112×59.7% |
| 16 |
| 160×59.7% |
| 16 |
| 16×5 |
| 59.7% |
| 44.8L |
| 22.4L/mol |
| 33.6L |
| 22.4L/mol |
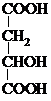 .
.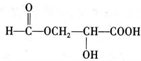 、
、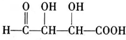 、
、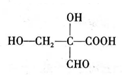 ,
, 、
、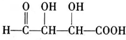 、
、 .
.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、酸性 | B、碱性 |
| C、氧化性 | D、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3 的摩尔质量是82g |
| B、1molH2O的质量是 18 g/mol |
| C、Cl- 的摩尔质量是35.5 g/mol |
| D、1molN2 的体积是 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SiO3胶体和NaCl溶液 |
| B、FeCl3溶液和Fe(OH)3胶体 |
| C、豆浆和蔗糖溶液 |
| D、CuSO4溶液和Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、③④ | C、②⑤ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
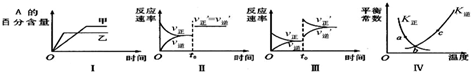
| A、图I表示温度对化学平衡的影响,且甲的温度较高 |
| B、图Ⅱ表示t0时刻缩小容器体积对反应速率的影响 |
| C、图Ⅲ表示t0时刻增大B浓度对反应速率的影响 |
| D、图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com