
【题目】请按照要求完成下列方程式。
(1)工业制取氯气的离子反应方程式:________________________________________。
(2)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:______________________________________。
(3)澄清石灰水中通入CO2变浑浊又变澄清的反应方程式:__________________________________________、____________________。
【答案】 2Cl-+ 2H2O![]() Cl2↑ + H2↑ + 2OH- SO42- + 2H+ + 2OH- + Ba2+ = BaSO4 ↓+ 2H2O Ca(OH)2 + CO2 = CaCO3 ↓+ H2O CaCO3 + CO2 + H2O = Ca(HCO3)2
Cl2↑ + H2↑ + 2OH- SO42- + 2H+ + 2OH- + Ba2+ = BaSO4 ↓+ 2H2O Ca(OH)2 + CO2 = CaCO3 ↓+ H2O CaCO3 + CO2 + H2O = Ca(HCO3)2
【解析】(1)工业制取氯气是利用电解饱和食盐水得到氢氧化钠、氯气和氢气,反应的离子反应方程式为:2Cl-+ 2H2O![]() Cl2↑ + H2↑ + 2OH-;(2)将NaHSO4溶液滴入氢氧化钡溶液中至中性生成硫酸钡、氯化钠和水,反应的离子反应方程式为:SO42- + 2H+ + 2OH- + Ba2+ = BaSO4 ↓+ 2H2O;(3)澄清石灰水中通入CO2变浑浊生成碳酸钙,后碳酸钙溶解又变澄清,发生的反应方程式为:Ca(OH)2 + CO2 = CaCO3 ↓+ H2O、 CaCO3 + CO2 + H2O = Ca(HCO3)2。
Cl2↑ + H2↑ + 2OH-;(2)将NaHSO4溶液滴入氢氧化钡溶液中至中性生成硫酸钡、氯化钠和水,反应的离子反应方程式为:SO42- + 2H+ + 2OH- + Ba2+ = BaSO4 ↓+ 2H2O;(3)澄清石灰水中通入CO2变浑浊生成碳酸钙,后碳酸钙溶解又变澄清,发生的反应方程式为:Ca(OH)2 + CO2 = CaCO3 ↓+ H2O、 CaCO3 + CO2 + H2O = Ca(HCO3)2。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图象正确的是( )
A.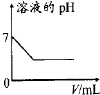
25℃时,向亚硫酸溶液中通入氯气
B.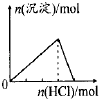
向NaAlO2溶液中通入HCl气体
C.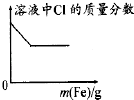
向少量氯化铁溶液中加入铁粉
D.
向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
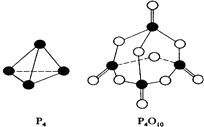
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要应用.某兴趣小组用0.50molL﹣1KI、0.2%淀粉溶液、0.20molL﹣1K2S2O8、0.10molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知: S2O82﹣+2I﹣═2SO42﹣+I2(慢) I2+2S2O32﹣═2I﹣+S4O62﹣(快)
(1)向KI,Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积/mL溶液 | ||||
K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | V1 | V3 | 4.0 | 2.0 |
③ | 8.0 | V2 | V4 | V5 | 2.0 |
表中V3、V4和V5取实验设计的体积数值,目的是 , 表中的V2= , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2 .
请回答下列问题:
a.向装置中通入N2 b.向三颈烧瓶中滴加稀硝酸 c.点燃酒精灯 d.熄灭酒精灯 e.停止通入氮气 f.关闭分液漏斗旋塞
(1)上述操作的正确排序为、c、、f、、 .
(2)B中盛放的试剂是 , 作用是除去(填化学式).
(3)装置E中,酸性K2Cr2O7溶液的作用:可将剩余的NO氧化成NO ![]() ,溶液由橙色变为绿色(Cr3+),反应的离子方程式是 .
,溶液由橙色变为绿色(Cr3+),反应的离子方程式是 .
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明D中有亚硝酸钙生成 .
(5)整个过程持续通入氮气的作用 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
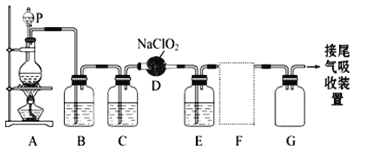
(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是____________________。
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
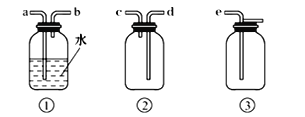
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com