
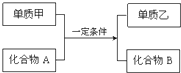
 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:分析 (1)单质甲是生活中用途最广泛的金属,应为Fe,单质乙是最轻的气体,应为H2,则甲与化合物的反应为铁与酸发生置换反应,符合转化关系;
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,且为置换反应,则A为H2O,甲为Na,乙为H2,B为NaOH;
(3)工业上利用置换反应原理制备一种半导体材料,常见反应为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)若化合物B为黑色磁性晶体,气体单质乙能在空气中燃烧,B为Fe3O4,乙为H2,甲和化合物A的反应为铁和水蒸气的反应.
解答 解:(1)单质甲是生活中用途最广泛的金属,应为Fe,单质乙是最轻的气体,应为H2,则甲与化合物的反应为铁与酸发生置换反应,符合转化关系,
故答案为:Fe;
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,且为置换反应,则A为H2O,甲为Na,乙为H2,B为NaOH,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)工业上利用置换反应原理制备一种半导体材料,常见反应为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)若化合物B为黑色磁性晶体,气体单质乙能在空气中燃烧,B为Fe3O4,乙为H2,甲和化合物A的反应为铁和水蒸气的反应,反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,
故答案为:3Fe3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2.
点评 本题以置换反应为载体考查了物质的推断,明确物质的性质是解本题关键,物质间的置换反应类型有:金属间的置换反应、非金属间的置换反应、金属和非金属之间的置换反应,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡状态时A、B、C、D的反应速率均为0 | |
| B. | C的平均反应速率为:0.15mol/(L•min) | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | 此时,V(A):V(B):V(C):V(D)=4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
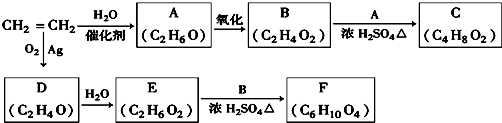
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应); ;D的一种同分异构体的结构简式为CH3CHO.
;D的一种同分异构体的结构简式为CH3CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
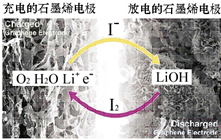 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH| A. | 放电时负极上I- 被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
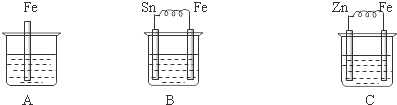
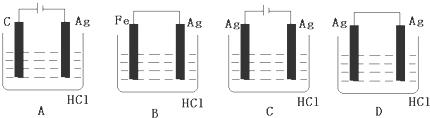
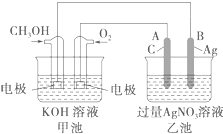
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3 KHCO3 KCl NH4Cl | |
| B. | K2CO3 KHCO3 NH4Cl KCl | |
| C. | (NH4)2SO4 NH4Cl KNO3 K2CO3 | |
| D. | NH4Cl (NH4)2SO4 K2CO3 KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com