
 如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:
如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:分析 以石墨作电极电解NaCl溶液,阳极反应式为2Cl--2e-=Cl2↑、2H++2e-=H2↑,
(1)通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体,能使湿润的淀粉碘化钾试纸变蓝色的气体是Cl2,所以B电极上生成Cl2,连接阳极的电源电极是正极、连接阴极的电源电极是负极;
(2)A是阴极,阴极上氢离子放电生成氢气;
(3)阳极上生成Cl2、阴极上生成H2,所以电解过程中相当于析出HCl,根据“析出什么加入什么”原则加入物质即可使溶液恢复原状;阳极生成n(Cl2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,根据转移电子守恒得阴极析出n(H2)=$\frac{0.01mol×2}{2}$=0.01mol,根据Cl原子守恒得相当于生成n(HCl)=2n(Cl2)=2×0.01mol=0.02mol,由m=nM计算需要HCl的质量.
解答 解:以石墨作电极电解NaCl溶液,阳极反应式为2Cl--2e-=Cl2↑、2H++2e-=H2↑,
(1)通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体,能使湿润的淀粉碘化钾试纸变蓝色的气体是Cl2,所以B电极上生成Cl2,连接阳极的电源电极是正极、连接阴极的电源电极是负极,所以a是负极、b是正极,
故答案为:负;
(2)A是阴极,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(3)阳极上生成Cl2、阴极上生成H2,所以电解过程中相当于析出HCl,根据“析出什么加入什么”原则加入物质即可使溶液恢复原状,所以应该通入HCl气体;阳极生成n(Cl2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,根据转移电子守恒得阴极析出n(H2)=$\frac{0.01mol×2}{2}$=0.01mol,根据Cl原子守恒得相当于生成n(HCl)=2n(Cl2)=2×0.01mol=0.02mol,m(HCl)=nM=0.02mol×36.5g/mol=0.73g,
故答案为:HCl;0.73.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应、各个物理量关系是解本题关键,难点是计算加入HCl质量,注意转移电子守恒、原子守恒的灵活运用.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:填空题
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示. (或
(或
 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 键能 |
| H-H | 436 |
| H-F | 565 |
| H-S | 339 |
| H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | B. | H(g)+F(g)→HF (g)+565kJ | ||
| C. | HF的热稳定性大于H2S | D. | H2S的沸点比H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发进行的反应一定不能发生 | |
| B. | 在一定条件下,非自发进行的反应也能进行 | |
| C. | 自发进行的反应一定迅速 | |
| D. | 凡是熵增加的过程都是自发过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
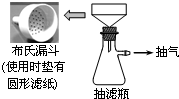 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
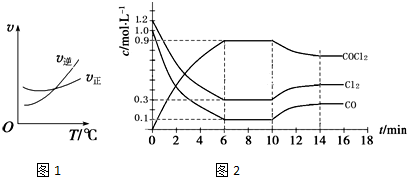
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
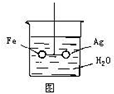 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com