
| 1 |
| 2 |
| 1 |
| 6 |
| a |
| 2 |
| 1 |
| 2 |
| a |
| 6 |
| a |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| 1 |
| 2 |
| a |
| 6 |
| a |
| 3 |
| a |
| 2 |
| a |
| 3 |
| a |
| 2 |
| ||
| 2min |
| a |
| 12 |
| 3 |
| 2 |
| 3 |
| 2 |
| a |
| 12 |
| a |
| 8 |
| a |
| 12 |
| a |
| 8 |
| a |
| b |
| a |
| b |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、CuSO4溶液吸收H2S气体 Cu2++H2S=CuS↓+2H+ |
| B、NH4HSO4溶液中加入等物质的量的Ba(OH)2 溶液NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| D、氧化铁溶于氢碘酸 Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移去部分SO3 |
| B、降低体系温度 |
| C、通入大量O2 |
| D、通入大量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:向盛有固体K2Cr2O7的A、B两试管中分别加入一定量的稀硫酸 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
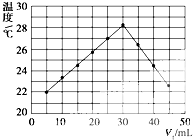 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com