
(6分)下表为元素周期表的一部分,期中的编号代表对应的元素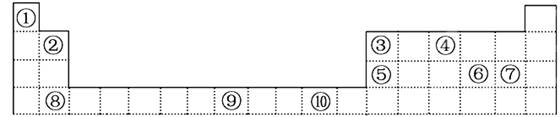
请回答下列问题:
(1)表中属于ds区的元素是________(填编号)。
(2)写出元素⑨的高价离子的电子排布式_____________________________。
(3)某元素的最外层电子排布式为nsnnpn+1,该元素原子的核外共有________种不同运动状态的电子。该元素在周期表中的位置是上表中相对应的 (填编号),该元素的气态氢化物沸点较高的原因是
(4)⑥、⑦分别①形成的化合物稳定性较强的为 (化学式表示)
(6分)(1)⑩
(2)1s22s22p63s23p63d5
(3)7 ④ NH3分子间存在氢键
(4)HCl
解析试题分析:(1)元素周期表中位于ds区的元素是第一、二副族元素,所以⑩位于ds区;
(2)⑨是Fe元素,最高价离子是Fe3+,核外有23个电子,排布式为1s22s22p63s23p63d5
(3)s轨道最多只能排2个电子,所以n=2,最外层电子排布式为nsnnpn+1,则该元素的最外层是2s22p3,该元素是N元素,核外有7个电子,就有7种不同的运动状态;是上表中的④;该元素的气态氢化物沸点较高的原因是NH3分子间存在氢键,使氨气的沸点升高;
(4)⑥、⑦分别是S、Cl元素,①是H元素,Cl的非金属性比S强,所以HCl比较稳定。
考点:考查元素周期表、原子结构、元素周期律的结合应用


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:单选题
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1:1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
卤族元素随着原子序数的增大,下列递变规律正确的是( )
| A.原子半径逐渐增大 | B.单质的氧化性逐渐增强 |
| C.单质熔、沸点逐渐降低 | D.气态氢化物稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(4)请写出下列物质的电子式。H2O CO2 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:C ;E 。
(2)化合物A2D的电子式为 。
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是 。
(4)B的最高价氧化物的结构式 。
(5)写出符合X2Y2的物质在MnO2催化作用下生成D单质的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | | | |||||
| | | | b | c | d | | |
| e | | f | | | g | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。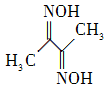
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。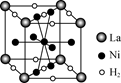
(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com